
| A、同温同压下,原子数均为NA的氢气和氦气具有相同的体积 |
| B、某密闭容器盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应,转移电子的数目为0.6NA |
| C、常温常压下,1 mol甲基(-14C1H3)所含的中子数和电子数分别为8NA、9NA |
| D、1.8 g重水(D2O)中含有中子数为NA |


科目:高中化学 来源: 题型:
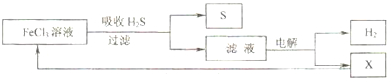
| A、吸收H2S的离子方程式为:Fe3++H2S═Fe2++S↓+2H+ |
| B、电解过程中的阳极反应主要为:2Cl--2e-═Cl2↑ |
| C、该工艺流程体现绿色化学思想 |
| D、实验室可用点燃充分燃烧的方法消除H2S污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③④ | B、②③⑤ |
| C、①④⑤ | D、①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:2:3 |
| B、6:3:2 |
| C、3:1:1 |
| D、1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.0L1.0mol/L的NaAlO2水溶液中含有的氧原子数为2NA |
| B、1L1mol/L的NaClO溶液中含有ClO-的数目为NA |
| C、常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA |
| D、常温常压下,8gO2含有2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
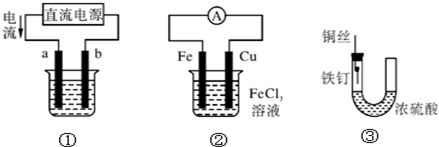
| A、用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 |
| B、用装置①进行电镀,镀件接在b极上 |
| C、装置②的总反应是:Cu+2Fe3+═Cu2++2Fe2+ |
| D、装置③中的铁钉几乎没被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.5 mol?L-1 |
| B、5 mol?L-1 |
| C、7.5 mol?L-1 |
| D、2 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O═3I2+6OH- | ||||
B、向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-
| ||||
| C、将过量SO2通入冷氨水中:SO2+NH3?H2O═HSO3-+NH4+ | ||||
| D、足量草酸与KOH反应:H2C2O4+2OH-═C2O42-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com