
分析 (1)草木灰中的钾盐可以溶于水中形成溶液,可以利用过滤的方法来获得钾盐的水溶液,加热蒸发可得到晶体;
(2)根据天平平衡的原理,把样品放在右盘,砝码放在左盘,若指针偏向右边,则右边重;
(3)悬浊液过滤后,滤液可能仍浑浊,为了得到澄清的溶液可选择重复操作;
(4)玻璃棒可用于搅拌、引流等作用;
(5)碳酸根离子和盐酸反应产生气体,硫酸根离子和盐酸酸化钡离子反应生成白色沉淀;氯离子和硝酸酸化的银离子反应生成白色沉淀
解答 解:(1)草木灰中的钾盐可以溶于水中形成溶液,然后利用过滤的方法可以获得钾盐的水溶液,将所得的水溶液蒸发结晶可以获得氯化钾的固体,
故答案为:过滤;蒸发;
(2)用托盘天平称量样品时,若指针偏向右边,则表示左盘轻、砝码重,故答案为:B;
(3)为了得到澄清的滤液,可选择重复过滤操作,故答案为:滤液可能仍浑浊,为了得到澄清的滤液;
(4)在过滤操作中,可以用玻璃棒来引流,在蒸发结晶操作中,用玻璃棒来搅拌,使溶液受热均匀,防止滤液飞溅,
故答案为:引流;搅拌,使溶液受热均匀,防止滤液飞溅;
(5)向原溶液中滴加盐酸酸化后再滴加氯化钡溶液,排除了其它阴离子的干扰,如果产生白色沉淀,就说明溶液中有硫酸根离子,向原溶液中滴加足量稀硝酸后,排除了其它离子的干扰,再加入 AgNO3 溶液,产生白色沉淀,说明溶液中有氯离子,故答案为:白色沉淀;SO42-;白色沉淀;Cl-.
点评 本题考查混合物的分离提纯,为高频考点,把握粗盐提纯实验及离子的检验为解答的关键,侧重分析与实验能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | H+、NH4+、I-、Fe3+ | B. | K+、Ag+、Cl-、NO3- | ||
| C. | ClO-、Fe2+、SO42-、Na+ | D. | Ba2+、Na+、OH-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 浓硫酸 NaCl+MnO2 AgNO3 | B. | NaOH溶液 Ca(HCO3)2 Ca(OH)2 | ||
| C. | NaOH溶液 (NH4)2SO4 KAl(SO4)2 | D. | 浓硫酸 NaCl H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
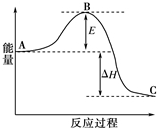 合成氨反应N2(g)+3H2(g)?2NH3(g),反应过程的能量变化如图所示.已知N2(g)与H2(g)反应生成17g NH3(g),放出46.1kJ的热量.
合成氨反应N2(g)+3H2(g)?2NH3(g),反应过程的能量变化如图所示.已知N2(g)与H2(g)反应生成17g NH3(g),放出46.1kJ的热量.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水导电能力比BaSO4的水溶液强,所以氨水是强电解质,BaSO4是弱电解质 | |
| B. | 已知H2C2O4是弱酸,其电离方程式为:H2C2O4?2H++C2O42- | |
| C. | 若反应C(s)+CO2(g)?2CO(g)在常温下不能自发,则该反应的△H>0 | |
| D. | 工业合成氨温度控制在500℃,目的是为了提高产率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷与氯气反应生成一氯甲烷 | B. | 苯与氢气反应生成环己烷 | ||
| C. | 乙烯与溴反应生成1,2-二溴乙烷 | D. | 乙醇与氧气反应生成乙醛 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com