
| A. | 观察焰色反应实验为黄色火焰,则可证明该溶液中含有Na+ | |
| B. | 金属单质导电与电解质溶液导电原因是一样的 | |
| C. | 常温下浓硫酸与铁不反应,故常温下可用铁制容器贮藏贮运浓硫酸 | |
| D. | 可用Na与MgCl2溶液反应制Mg |
分析 A、钠元素焰色反应为黄色;
B、金属导电是自由电子定向移动,电解质溶液导电是溶液中离子发生氧化还原反应;
C、铁常温下在浓硫酸中发生钝化现象是发生了氧化还原反应;
D、钠和水溶液中的水反应生成氢氧化钠和氢气.
解答 解:A、钠元素焰色反应为黄色,观察焰色反应实验为黄色火焰,则可证明该溶液中含有Na+,故A正确;
B、金属导电是自由电子定向移动,电解质溶液导电是溶液中离子发生氧化还原反应,金属单质导电与电解质溶液导电原因不同,故B错误;
C、铁常温下在浓硫酸中发生钝化现象是发生了氧化还原反应,氧化膜阻止反应进行,故常温下可用铁制容器贮藏贮运浓硫酸,故C错误;
D、钠和水溶液中的水反应生成氢氧化钠和氢气,氢氧化钠和氯化镁反应生成氢氧化镁沉淀,不能置换镁,故D错误;
故选A.
点评 本题考查了物质性质的分析判断,主要是金属性质的理解应用,注意钝化现象是发生了氧化还原反应,题目较简单.


科目:高中化学 来源: 题型:解答题
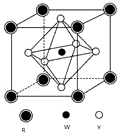 前四周期元素X、Y、Z、W、R的原子序数依次增大,已知:X原子的2p轨道为半充满状态;Y原子的L层有2个未成对电子;Z与Y位于同主族;W的+2价简单离子核外电子层排布与Ar原子相同;R原子的d轨道上有3个空轨道.请回答下列问题:
前四周期元素X、Y、Z、W、R的原子序数依次增大,已知:X原子的2p轨道为半充满状态;Y原子的L层有2个未成对电子;Z与Y位于同主族;W的+2价简单离子核外电子层排布与Ar原子相同;R原子的d轨道上有3个空轨道.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 结构与性质 |
| Q | Q元素的最高正、负价代数和为0.最高价氧化物为温室气体之一• |
| W | W是地壳中含量最高的非金属元素. |
| Y | Y所处的周期序数与主族序数相等,为地壳中含量最高的金属元素. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.18 g | B. | 2.12 g | C. | 4.22 g | D. | 5.28 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ②④ | B. | ②③⑤ | C. | ①②③⑤ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨中含有NH3、NH4+、NH2-微粒 | |
| B. | 其他条件不变,若增加液氨的量,电离平衡将正向移动 | |
| C. | 只要不加入其他物质,液氨中c(NH4+)=c(NH2-) | |
| D. | 一定温度下液氨中c(NH4+)•c(NH2-)是一个常数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水久置后黄绿色消失 | |
| B. | 淀粉溶液遇碘单质变蓝 | |
| C. | SO2使品红溶液褪色 | |
| D. | 溴水中加入CCl4溶液,振荡静置后,上层呈橙红色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com