
 ,它是由极性共价键形成的极性分子.
,它是由极性共价键形成的极性分子. ,写出该反应的化学方程式IBr+H2O=HBr+HIO.
,写出该反应的化学方程式IBr+H2O=HBr+HIO. 分析 (1)I和Br的电负性相差不大,形成的化学键是极性共价键,根据共价化合物的成键特点书写电子式;
(2)溴化碘(IBr)的化学性质类似于卤素单质,得知溴化碘和水反应生成次碘酸和溴化氢,据此写出反应的化学方程式,结合HClO书写HIO的电子式.
解答 解:(1)I和Br的电负性相差不大,形成的化学键是极性共价键,电子式为 ,是极性共价键形成的极性分子,
,是极性共价键形成的极性分子,
故答案为: ;极性共价;极性;
;极性共价;极性;
(2)根据卤素单质和水之间反应生成次卤酸和卤化氢,由于Br比I的电负性大,IBr中I为+1价,Br为-1价,则溴化碘与水反应生成HBr和HIO,其反应的化学方程式为:IBr+H2O=HBr+HIO,三原子分子为次碘酸,属于共价化合物,电子式为: ,
,
故答案为: ;IBr+H2O=HBr+HIO.
;IBr+H2O=HBr+HIO.
点评 本题考查IBr的结构,把握卤素元素及化合物结构与性质的相似性为解答的关键,侧重分析与迁移应用能力的考查,题目难度不大.


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:实验题
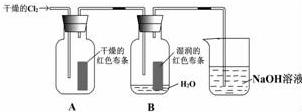 某同学设计了如图的实验:
某同学设计了如图的实验:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
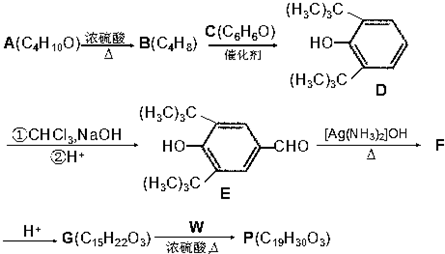
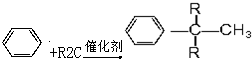 (R为烷基)
(R为烷基)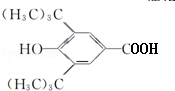 ;E中含有的官能团名称是羟基和醛基;
;E中含有的官能团名称是羟基和醛基;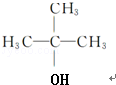 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +H2O;该反应类型为消去反应;
+H2O;该反应类型为消去反应;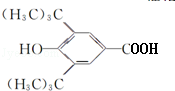 +CH3CH2CH2CH2OH$→_{△}^{浓H_{2}SO_{4}}$
+CH3CH2CH2CH2OH$→_{△}^{浓H_{2}SO_{4}}$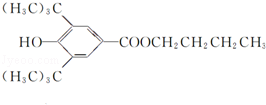 +H2O;该反应类型为酯化反应;
+H2O;该反应类型为酯化反应;查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 N2H4(肼)可作用制药的原料,也可作火箭的燃料.(1)肼能与酸反应.N2H6Cl2溶液呈弱酸性,在水中存在如下反应:
N2H4(肼)可作用制药的原料,也可作火箭的燃料.(1)肼能与酸反应.N2H6Cl2溶液呈弱酸性,在水中存在如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
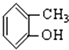 ⑥
⑥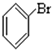 ⑦
⑦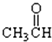 ⑧
⑧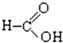 ⑨
⑨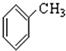 ⑩
⑩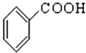
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

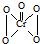 ,该反应
,该反应查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R的单质在通常情况下呈气态 | B. | R的单质可能是一种无色的固体 | ||
| C. | R的氢化物稳定 | D. | 单质R与H2的化合反应非常困难 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | 该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ClO-=HClO+CH3COO- | |
| C. | 该消毒液与洁厕灵(成分为HCl)混用,产生Cl2:2H++Cl-+ClO-=Cl2↑+H2O | |
| D. | 该消毒液的pH约为12:ClO-+H2O?HClO+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
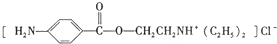 )是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下:
)是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下: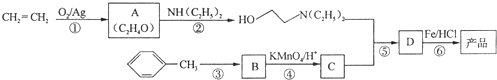
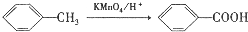
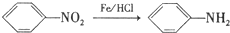

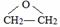 .
.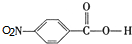 ,C中含有的含氧官能团的名称为硝基、羧基.
,C中含有的含氧官能团的名称为硝基、羧基. +HOCH2CH2N(C2H5)2$\stackrel{一定条件下}{→}$
+HOCH2CH2N(C2H5)2$\stackrel{一定条件下}{→}$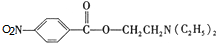 +H2O.
+H2O.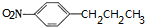 (任写一种).
(任写一种).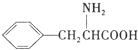 )是人体必需的氨基酸之一,写出其发生缩聚反应的化学方程式
)是人体必需的氨基酸之一,写出其发生缩聚反应的化学方程式 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com