
| O2 |
| 反应Ⅰ |
| CO(NH2)2 |
| 反应Ⅱ |

| 2 |
| 3 |
| 1 |
| 3 |
| V |
| 22.4 |
| 1000a×(5-3) |
| 46 |
| V |
| 22.4 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、25℃时,向等浓度的MgCl2和FeCl3混合溶液中逐滴加入氨水,先出现红褐色沉淀 |
| B、25℃时,MgCl2溶液中有少量FeCl3时,可以加入MgO进行除杂 |
| C、25℃时,加大量水稀释氨水,电离程度增大,溶液导电能力增强 |
| D、25℃时,NH4++H2O?NH3?H2O+H+的平衡常数为5.6×10-10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分馏、蒸馏、煤的液化都是物理变化,干馏、裂化、裂解都是化学变化 |
| B、乙烯和聚乙烯均能和溴水发生加成反应而使溴水褪色 |
| C、需要加热的反应不一定是吸热反应 |
| D、根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 验证化学能转化为电能 |
B、 比较硫、碳、硅三种元素的非金属行强弱 |
C、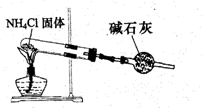 实验室制取NH3 |
D、 分离沸点不同且互溶的液体混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若混合后呈中性,测混合后的溶液中一定存在:c(Na+)=c(CH3COO-)>c(OH-)=c(H+) |
| B、若混合后呈酸性,则混合后的溶液中可能存在:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) |
| C、若混合后呈碱性,则混合后的溶液中可能存在:c(Na+)>c(OH-)>c(CH3COO-)>c(CH3COOH) |
| D、若混合后的溶液中存在c(CH3COO-)+c(CH3COOH)=2c(Na+),则也一定存在c(OH-)+c(CH3COO-)=c(CH3COOH)+c(H+)等式 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,10 mL 0.02 mol?L-1 HCl溶液与10 mL 0.02 mol?L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12 |
| B、常温下,向AgCl的饱和溶液中加入NaCl固体,有固体析出,且AgCl的Ksp变小 |
| C、在0.1 mol?L-1 CH3COONa溶液中,c(OH-)>c(CH3COOH)+c(H+) |
| D、常温下pH=4的NaHC2O4溶液中:c(H2C2O4)>c(C2O42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X、M两元素的简单气态氢化物的稳定性:X<M |
| B、X、Y、M的最高价氧化物的水化物的酸性:X>Y>M |
| C、Z、W的单质均可在冷的浓硝酸中钝化 |
| D、Z、W、M 的单质均能与NaOH溶液反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com