
 已知某醇燃料含有碳、氢、氧三种元素.为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如下表所列的实验结果(假设产生的气体完全被吸收):
已知某醇燃料含有碳、氢、氧三种元素.为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如下表所列的实验结果(假设产生的气体完全被吸收):| 实验前 | 实验后 | |
| (干燥剂+U形管)的质量 | 101.1g | 102.9g |
| (澄清石灰水+广口瓶)的质量 | 312.0g | 314.2g |
| 2.2g |
| 44g/mol |
| 2 |
| 18 |
| 0.2g |
| 1g/mol |


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:
 有如下化学反应:2A(g)+B(g)??2C(g)(正反应为放热反应).
有如下化学反应:2A(g)+B(g)??2C(g)(正反应为放热反应).查看答案和解析>>
科目:高中化学 来源: 题型:
 为了节能减排、缓解能源短缺,我国大力开发甲醇等可再生的新能源.工业上根据CO(g)+2H2(g)═CH3OH(g)△H合成甲醇.
为了节能减排、缓解能源短缺,我国大力开发甲醇等可再生的新能源.工业上根据CO(g)+2H2(g)═CH3OH(g)△H合成甲醇.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
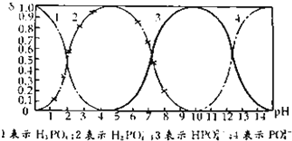 磷酸(H3PO4)在溶液中能够以H3PO4、H2PO4-、HPO42-和PO43-四种粒子的形式存在,当溶液中的pH发生变化时,其中任一种粒子的物质的量占四种粒子总物质的量的分数δ也可能发生变化.如图所示是H3PO4溶液中,各种粒子的物质的量分数δ随pH变化曲线:
磷酸(H3PO4)在溶液中能够以H3PO4、H2PO4-、HPO42-和PO43-四种粒子的形式存在,当溶液中的pH发生变化时,其中任一种粒子的物质的量占四种粒子总物质的量的分数δ也可能发生变化.如图所示是H3PO4溶液中,各种粒子的物质的量分数δ随pH变化曲线:| c(Na+) |
| c(PO43-) |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 放电 |
| 充电 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在反应KIO3+6 HI=KI+3I2十3 H2O中,每生成3mo1 I2转移的电子数为5NA |
| B、100mL 18.4mo1?L-1硫酸与足量Cu反应,生成SO2的分子数为0.92NA |
| C、1 L 0.1 moI?L-1的CH3COOH溶液中所含的离子和分子总数为0.1NA |
| D、将0.lmol FeC13滴人沸水中可制得0.1NA Fe(OH)3胶粒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、不含其他杂质的天然油脂属于纯净物 |
| B、肥皂的有效成分硬脂酸钠和甘油 |
| C、油脂的烃基部分饱和程度越大,熔点越低 |
| D、各种油脂水解后的产物中都有甘油 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com