
某待测溶液(阳离子为Na+)中可能含有SO42﹣、SO32﹣、NO3﹣、Cl﹣、Br﹣、CO32﹣、HCO3﹣中的一种或多种,进行如图所示的实验,每次实验所加试剂均过量,下列说法不正确的是( )
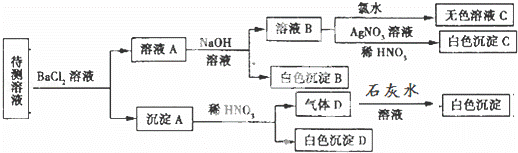
A. SO42﹣、SO32﹣至少含有一种
B. 沉淀B的化学式为BaCO3
C. 肯定存在的阴离子有CO32﹣、HCO3﹣、Cl﹣,还有SO42﹣、SO32﹣至少含有一种
D. 肯定没有的离子是Br﹣
考点: 常见阴离子的检验;常见阳离子的检验.
分析: 待测液和氯化钡溶液反应得到沉淀A,则溶液中可能含有CO32﹣、SO32﹣、SO42﹣,向沉淀中加入稀硝酸生成气体,且有部分沉淀不溶解,则溶液中存在CO32﹣,可能存在SO32﹣、SO42﹣中的两种或一种,根据离子共存知,溶液中不存在Ba2+;
滤液A中有Ba2+,加入过量的NaOH溶液得到白色沉淀B,则溶液中一定含有HCO3﹣,白色沉淀B为BaCO3,滤液B中通入氯气,得无色溶液,溶液中一定没有Br﹣,滤液B中加入硝酸银、硝酸溶液得到白色沉淀,白色沉淀为AgCl,说明滤液B中含有Cl﹣,由于加入氯化钡溶液,不能确定原溶液中是否含有Cl﹣,据此进行解答.
解答: 解:待测液和氯化钡溶液反应得到沉淀A,则溶液中可能含有CO32﹣、SO32﹣、SO42﹣,向沉淀中加入稀硝酸生成气体,且有部分沉淀不溶解,则溶液中存在CO32﹣,可能存在SO32﹣、SO42﹣中的两种或一种,根据离子共存知,溶液中不存在Ba2+;
滤液A中有Ba2+,加入过量的NaOH溶液得到白色沉淀B,则溶液中一定含有HCO3﹣,白色沉淀B为BaCO3,滤液B中通入氯气,得无色溶液,溶液中一定没有Br﹣,滤液B中加入硝酸银、硝酸溶液得到白色沉淀,白色沉淀为AgCl,说明滤液B中含有Cl﹣,由于加入氯化钡溶液,不能确定原溶液中是否含有Cl﹣,
A、根据以上分析可知,待测液中至少存在SO32﹣、SO42﹣中的一种,故A正确;
B、根据分析可知,沉淀B为碳酸氢根离子与钡离子、氢氧根离子反应生成的BaCO3,反应的离子方程式为:HCO3﹣+OH﹣+Ba2+=BaCO3↓+H2O,故B正确;
C、根据分析可知,肯定存在的离子为:CO32﹣、HCO3﹣,不能确定Cl﹣是否存在,故C错误;
D、根据分析可知,待测液中一定不存在的离子为:Br﹣,故D正确,故选C.
点评: 本题考查了常见离子的检验、离子共存的判断等知识,题目难度中等,注意掌握常见离子的化学性质及检验方法,正确分析框图中的转化关系及反应现象是解答本题的关键.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
下列离子在溶液中能大量共存的是( )
A. H+、A1O2﹣、Na+、Cl﹣
B. 强碱性溶液:Na+、HCO3﹣、SO42﹣
C. Fe2+、Fe3+、Na+、NO3﹣
D. Fe2+、NH4+、Cl﹣、OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
广口瓶是中学实验中常用仪器之一,下列各装置中均有广口瓶,请填空:
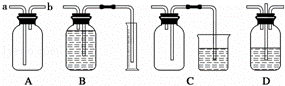
(1)装置A可用于收集气体,如H2,若装置A是干燥的,则气体应从 口进入(填“a”或“b”,下同),若A中充满水,则气体应从 口进入.
(2)装置B通常用于 ,注意事项是 .(写出两条)
(3)装置C的用途是 .
(4)装置D中长导管的作用是 ) .
查看答案和解析>>
科目:高中化学 来源: 题型:
在复杂的体系中,确认化学反应先后顺序有利于解决问题,下列化学反应先后顺序判断正确的是( )
A. 在含等物质的量的AlO2﹣、OH﹣、CO32﹣的溶液中,逐滴加入盐酸:AlO2﹣、OH﹣、CO32﹣
B. 在含等物质的量的FeBr2、Fel2的溶液中,缓慢通入氯气:I﹣、Br﹣、Fe2+
C. 在含等物质的量的Ba(OH)2、KOH的溶液中,缓慢通入CO2:KOH、Ba(OH)2、K2CO3、BaCO3
D. 在含等物质的量的Fe3+、Cu2+、H+的溶液中加入锌粉:Fe3+、Cu2+、H+、Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
铁和氧化铁的混合物共a mol,加盐酸后固体全部溶解,共收集到氢气bmol,且向反应后的溶液中加入KSCN溶液不显红色,则原混合物中单质铁的物质的量为( )
A.  mol B. (a﹣b)mol C.
mol B. (a﹣b)mol C.  mol D. (a+b)mol
mol D. (a+b)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
某种镁矿石的主要成分是碳酸镁,还含有较多的脉石(SiO2)和少量石灰石.图1所示是利用该镁矿石制备七水硫酸镁(MgSO4•7H2O)的工艺流程,图2是CaSO4和MgSO4的溶解度曲线.
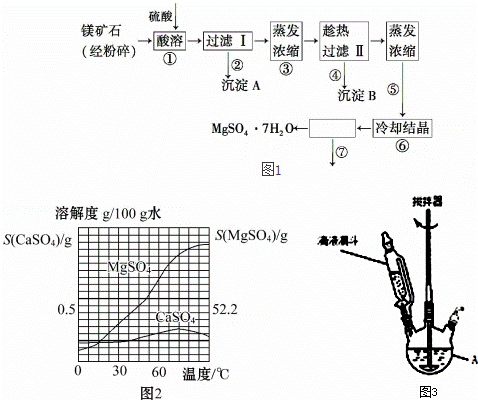
根据以上信息回答下列问题:
(1)步骤①可在图3装置中进行,仪器A的名称是 ,硫酸要分批缓慢加入的原因是 防 ,矿石要粉碎和反应过程中不断搅拌的主要目的是 ,碳酸镁与硫酸反应的化学方程式 .
(2)沉淀A的成分是SiO2和少量的 ,
(3)上述流程中多次用到了过滤操作,实验室过滤时需要用到的玻璃仪器是玻璃棒、烧杯和 .步骤④趁热过滤的作用是 .
(4)步骤⑦的操作名称是过滤、 、 .过滤操作时需将步骤⑥中冷却结晶后的溶液和晶体转移到漏斗中,最后器壁上往往还沾有少量晶体,需选用一种液体将器壁上的晶体淋洗并倾入漏斗中,下列液体最合适的是
A.冰水 B.滤液 C.稀硫酸 D.无水乙醇
(5)步骤⑦中洗涤晶体时,先冰水洗,后用酒精洗,用冰水洗的目的:①除去晶体表面的硫酸等杂质,② ,用酒精洗的目的是
(6)步骤⑦不宜采用加热干燥的方法,可能的原因是 .
(7)晶体中所含结晶水可通过重量分析法测定,主要步骤有:①称量,②置于烘箱中脱结晶水,③冷却,④称量,⑤重复②~④至恒重,⑥计算.步骤③需要在干燥器中进行,理由是 ;步骤⑤的目的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
)实验室制取H2的反应方程式为:Zn+H2SO4═ZnSO4+H2↑.
(1) 是氧化剂; 是还原剂; 元素被氧化; 元素被还原; 是氧化产物; 是还原产物.
(2)用双线桥表示出该反应电子转移的方向和数目 :Zn+H2SO4═ZnSO4+H2.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com