
【题目】浓度均为0.10mol·L-1、体积均为V0的MOH与ROH溶液,分别加水稀释至体积V,pH随lg(V/ V0)的变化如图所示,下列叙述错误的是( )
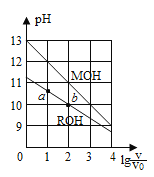
A.MOH的碱性强于ROH的碱性
B.ROH的电离程度:b点大于a点
C.若两溶液无限稀释,则它们的c(OH-)相等
D.当lg(V/ V0))=2时,若两溶液同时升高温度,则c(M+)/c(R+)增大
【答案】D
【解析】
试题分析:A.相同浓度的一元碱,碱的pH越大其碱性越强,根据图知,未加水时,相同浓度条件下,MOH的pH大于ROH的pH,说明MOH的电离程度大于ROH,则MOH的碱性强于ROH的碱性,故A正确;B.由图示可以看出ROH为弱碱,弱电解质在水溶液中随着浓度的减小其电离程度增大,b点溶液体积大于a点,所以b点浓度小于a点,则ROH电离程度:b>a,故B正确;C.若两种溶液无限稀释,最终其溶液中c(OH-)接近于纯水中c(OH-),所以它们的c(OH-)相等,故C正确;D.根据A知,碱性MOH>ROH,当lg(V/ V0)=2时,由于ROH是弱电解质,升高温度能促进ROH的电离,所以c(M+)/c(R+)减小,故D错误;故选D。


科目:高中化学 来源: 题型:
【题目】在含有1molFeSO4的溶液中投入一小块金属钠,反应完全后,滤出沉淀并洗涤之,然后在空气中灼烧沉淀得到的固体物质是( )
A. Fe B. FeO C. Fe(OH)3 D. Fe2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果汁是人们喜爱的饮料,由于此饮料中含有Fe2+,现榨的苹果汁在空气中会由浅绿色变为棕黄色。若榨汁时加入维生素C,可有效防止这种现象发生。这说明谁生素C具有
A.氧化性 B.还原性 C.碱性 D.酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E是化学中常见的物质,常温下,E是一种无色无味的液体,它们之间有如下反应关系。
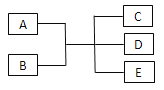
(1)若A是一种红色金属单质,B是一种常见的挥发性酸,反应时生成的C是无色气体,反应的离子方程式为___________,若反应放出1.12 L气体(标准状况下),则被还原的B物质的量为___________mol。
(2)若实验室中利用固体A和B的反应制备气体C,C是一种无色、刺激性气味、密度比空气小、碱性的气体,试写出此反应的化学方程式________________;实验室检验C的方法为_______________。
(3)若B是黄绿色有毒气体,上述关系经常用于实验室尾气处理,则反应的离子方程式为________________。若用湿润的淀粉碘化钾试纸靠近盛满B的试管口,看到的现象为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】要使相同物质的量浓度的Na2SO4溶液和Al2(SO4)3溶液中所含SO42-的数目相同,则所取两溶液的体积比是
A.3∶1 B.1∶3 C.3∶2 D.2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质性质变化的比较中,正确的是( )
A.酸性强弱HIO4<HBrO4<HClO4
B.原子半径大小S>Na>O
C.碱性强弱KOH<NaOH<LiOH
D.金属性强弱Na<Mg<Al
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)从海水中可提取多种化工原料,下面是工业上对海水的几项综合利用的示意图。

Ⅰ.海水所得粗盐中含Ca2+、Mg2+、SO![]() - 等杂质,为了有效除去Ca2+、Mg2+、SO
- 等杂质,为了有效除去Ca2+、Mg2+、SO![]() -,加入试剂的合理顺序为___________。
-,加入试剂的合理顺序为___________。
A.先加NaOH,后加Na2CO3,再加Ba2+试剂
B.先加NaOH,后加Ba2+试剂,再加Na2CO3
C.先加Ba2+试剂,后加NaOH,再加Na2CO3
要除去SO![]() -,必须添加钡试剂,该钡试剂可以是___________。
-,必须添加钡试剂,该钡试剂可以是___________。
A.Ba(OH)2 B. Ba(NO3)2 C.BaCl2
Ⅱ.写出用Ca(OH)2制取氢氧化镁的化学方程式:_____________________。
从经济效益角度看,该化工厂的厂址应选择在__________________。
(2)海藻中提取碘的流程如图:
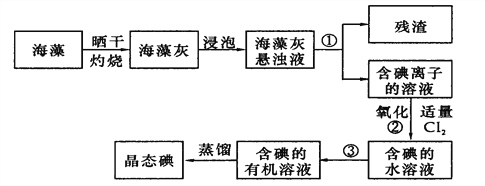
指出提取碘的过程中有关实验操作名称:①__________,③__________;
写出过程②中有关反应的离子方程式____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积恒定的密闭容器中,一定量的SO2与1.25mol O2在催化剂作用下加热到600℃发生反应:2SO2(g)+O2(g)![]() 2SO3(g) △H<0。当气体的物质的量减少0.45mol时反应达到平衡,在相同的温度下测得气体压强为反应前的80%。下列有关叙述正确的是( )
2SO3(g) △H<0。当气体的物质的量减少0.45mol时反应达到平衡,在相同的温度下测得气体压强为反应前的80%。下列有关叙述正确的是( )
A. 该温度下的平衡常数为101.25 L/moL
B. 达到平衡时,SO2的转化率是90%
C. 降低温度,正反应速率减小程度比逆反应速率减小程度大
D. 将平衡混合气体通入过量BaCl2溶液中,得到沉淀的质量一定为231.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚和乙醇是同分异构体,其鉴别可采用化学方法及物理方法,下列鉴别方法中不能对二者进行鉴别的是( )
A.利用金属钠或者金属钾
B.利用质谱法
C.利用红外光谱法
D.利用核磁共振氢谱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com