
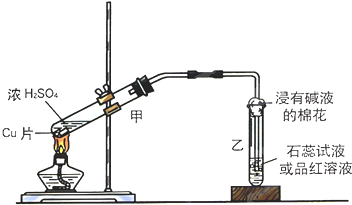
 实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验.
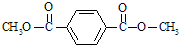
实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验.分析 (1)二氧化硫为酸性氧化物,能够使石蕊试液变红,能够使品红溶液褪色;硫酸铜溶液为蓝色溶液;
(2)二氧化硫与碳酸钠溶液反应生成亚硫酸钠和二氧化碳,据此写出反应的化学方程式.
解答 解:(1)二氧化硫具有漂白性,能够使品红溶液褪色,若浸有品红溶液的棉花褪色或浸有石蕊试液的棉花变红,则证明反应中生成的二氧化硫;
硫酸铜溶液为蓝色溶液,则甲装置中溶液变成蓝色,则证明反应生成了硫酸铜,
故答案为:浸有品红溶液的棉花褪色或浸有石蕊试液的棉花变红;甲装置中的溶液变为蓝色;
(2)二氧化硫有毒,利用蘸有碳酸钠浓溶液的棉花放在试管口处,能吸收二氧化硫,防止二氧化硫污染空气,反应的化学方程式为:SO2+Na2CO3═Na2SO3+CO2,
故答案为:SO2+Na2CO3═Na2SO3+CO2.
点评 本题考查了浓硫酸的性质,题目难度中等,明确铜与浓硫酸的反应为解答关键,注意掌握浓硫酸的性质、二氧化硫的检验方法,试题培养了学生灵活应用基础知识的能力.


科目:高中化学 来源: 题型:解答题
 .
.
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | O2(PtF6)晶体中含有离子键 | |
| B. | O2(PtF6)中氧元素的化合价为+1价 | |
| C. | 在此反应中,O2是氧化剂,PtF6是还原剂 | |
| D. | 反应中,每生成1mol O2(PtF6)转移1mol电子 |
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三上学期第13次周测理科综合化学试卷 题型:选择题
常温下,向1L0.1mol·L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3·H2O的变化趋势如图所示(不考虑溶液体积变化和氨的挥发),下列说法正确的是
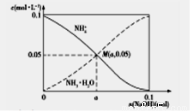
A.在M点时,n(OH-)-n(H+)=(a-0.05)mol
B.M点溶液中水的电子程度比原溶液的大
C.随着NaOH的加入,c(H+)/c(NH4+)不断增大
D.当n(NaOH)=0.mol时,c(OH-)=c(Cl-)-c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江省哈尔滨市高三上学期期中考试化学试卷(解析版) 题型:简答题
已知A、B、C、D、E、F、G都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素。A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子,G的+1价阳离子正好充满K,L,M三个电子层。回答下列问题:
(1)A、B、C、D、E、F、G几种元素中第一电离能最小的是(填元素符号),D元素的原子核外有种不同运动状态的电子;有种不同能级的电子。基态的F3+核外电子排布式是。
(2)B的气态氢化物在水中的溶解度远大于A、C的气态氢化物,原因是。
(3)化合物ECAB中的阴离子与AC2互为等电子体,该阴离子的电子式是。
(4)FD3与ECAB溶液混合,得到含多种配合物的血红色溶液,其中配位数为5的配合物的化学式是。
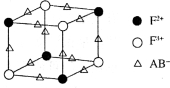
(5)化合物EF[F(AB)6]是一种蓝色晶体,右图表示其晶胞的1/8(E+未画出)。该蓝色晶体的一个晶胞中E+的个数为。
(6)G的二价阳离子能与乙二胺(H2N—CH2一CH2—NH2)形成配离子:
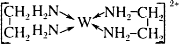
该配离子中含有的化学键类型有。(填字母)
a.配位键
B.极性键
C.离子键
D.非极性键
阴离子CAB-中的A原子与乙二胺(H2N—CH2一CH2—NH2)中C原子的杂化方式为。
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江省哈尔滨市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.pH=3和pH=4的盐酸各10mL混合,所得溶液的pH=3.5
B.溶液中c(H+)越大,pH值也越大,溶液的酸性就越强
C.液氯虽然不导电,但溶解于水后导电情况良好,因此,液氯也是强电解质
D.当温度不变时,在纯水中加入强碱溶液不会影响水的离子积常数
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1的醋酸加水稀释,$\frac{c({H}^{+})}{c(O{H}^{-})}$减小 | |
| B. | 体积、pH均相同的醋酸和盐酸完会溶解等量的镁粉(少量),后者用时少 | |
| C. | 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw变大 | |
| D. | 常温下,V1 L pH=11的NaOH溶液与V2 L pH=3的HA溶液混合,若混合液显中性,则V1≤V2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 OH-+H3PO4
OH-+H3PO4 CH3COO-+NH4+.
CH3COO-+NH4+.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com