
【题目】硫代硫酸钠(![]() )可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等.它易溶于水,难溶于乙醇,受热易分解,在酸性溶液中不能稳定存在.某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如下图:
)可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等.它易溶于水,难溶于乙醇,受热易分解,在酸性溶液中不能稳定存在.某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如下图:

实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节分液的滴速,使反应产生的![]() 气体较均匀地通入
气体较均匀地通入![]() 和
和![]() 的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸。
的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸。
②直至析出的浑浊不再消失,并控制溶液的![]() 接近7时,停止通入
接近7时,停止通入![]() 气体。
气体。
③趁热过滤,将滤液加热浓缩,冷却析出![]() 。
。
④再经过滤、洗涤、干燥,得到所需的产品。
(1)仪器A的名称是_________。
(2)为了保证硫代硫酸钠的产量,实验中不能让溶液![]() ,请用离子方程式表示原因_________。
,请用离子方程式表示原因_________。
(3)写出三颈烧瓶B中制取![]() 反应的总化学反应方程式_________。
反应的总化学反应方程式_________。
(4)为了验证固体硫代硫酸钠工业产品中含有碳酸钠,选用下列装置进行实验:

①实验装置的连接顺序依次_________(填装置的字母代号,各装置限用一次),装置C中的试剂为_________。
②能证明固体中含有碳酸钠的实验现象是_________。
③若要检验固体硫代硫酸钠工业产品中含有![]() ,需先加水配成稀溶液,再依次加入的试剂为_________、_________和品红溶液。
,需先加水配成稀溶液,再依次加入的试剂为_________、_________和品红溶液。
(5)![]() 常用作脱氯剂,在溶液中易被
常用作脱氯剂,在溶液中易被![]() 氧化成
氧化成![]() ,该反应的离子方程式为_________。
,该反应的离子方程式为_________。
【答案】蒸馏烧瓶 ![]()
![]() ADCB 品红(或高锰酸钾) C中品红溶液不褪色(高锰酸钾不褪色),B中澄清石灰水变浑浊 氯化钡溶液(或氯化钙溶液) 盐酸
ADCB 品红(或高锰酸钾) C中品红溶液不褪色(高锰酸钾不褪色),B中澄清石灰水变浑浊 氯化钡溶液(或氯化钙溶液) 盐酸 ![]()
【解析】
该实验的目的是制取![]() ,(1)、(2)、(3)、(5)都属于基础题目,运用已学知识答题即可;(4)该实验目的是为了验证固体硫代硫酸钠工业产品中含有碳酸钠,而碳酸钠的检验方法是加酸,再用澄清石灰水检验生成的CO2,而硫代硫酸钠遇酸分解,产生的SO2会影响CO2的检验,故需要先出去SO2,以排除SO2的干扰。
,(1)、(2)、(3)、(5)都属于基础题目,运用已学知识答题即可;(4)该实验目的是为了验证固体硫代硫酸钠工业产品中含有碳酸钠,而碳酸钠的检验方法是加酸,再用澄清石灰水检验生成的CO2,而硫代硫酸钠遇酸分解,产生的SO2会影响CO2的检验,故需要先出去SO2,以排除SO2的干扰。
(1)仪器A是蒸馏烧瓶;
(2)题中告知Na2S2O3在酸性溶液中不稳定,是因为![]() ;
;
(3)制取Na2S2O3的总反应为![]() ;
;
(4)该实验目的是为了验证固体硫代硫酸钠工业产品中含有碳酸钠,而碳酸钠的检验方法是加酸,再用澄清石灰水检验生成的CO2,而硫代硫酸钠遇酸分解,产生的SO2会影响CO2的检验,故需要先出去SO2,以排除SO2的干扰,则:
①实验装置的连接顺序依次为ADCB;A为发生装置,烧瓶中的试剂为固体硫代硫酸钠工业产品,分液漏斗中的试剂为硫酸;D中KMnO4溶液是为了除去SO2,C中的试剂应为品红溶液或KMnO4溶液,用来验证SO2已被吸收完全,从而说明和D中澄清石灰水反应的全部是CO2;
②证明工业产品中有Na2CO3,需要确保和D中澄清石灰水反应的全部是CO2,则对应的现象为C中试剂不褪色,D中澄清石灰水变浑浊;
③实验室检验SO32-的方法为加酸,检验SO2,因此若要固体硫代硫酸钠工业产品中含有Na2SO3,需要将SO32-从工业产品中分离出来,再将SO32-转化为SO2,并检验SO2气体;故将固体硫代硫酸钠工业产品配成溶液后,依次需要加入的试剂为BaCl2(或CaCl2)溶液、稀盐酸和品红溶液;
(5)![]() 常用作脱氯剂,相关的离子方程式为
常用作脱氯剂,相关的离子方程式为![]() 。
。


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
(1)热分解法制氢。某温度,H2O(g) ![]() H2(g)+1/2O2(g)。该反应平衡常数表达式K=_____
H2(g)+1/2O2(g)。该反应平衡常数表达式K=_____
(2)热化学循环制氢。制备H2的反应步骤如下:
①Br2(g) + CaO(s) = CaBr2(s) + 1/2O2(g) ΔH=-73 kJ·mol-1
②3FeBr2(s) + 4H2O(g) = Fe3O4(s) + 6HBr(g) + H2(g) ΔH=+384 kJ·mol-1
③CaBr2(s) + H2O (g) = CaO(s) + 2HBr(g) ΔH=+212 kJ·mol-1
④Fe3O4(s)+8 HBr(g) = Br2(g) + 3FeBr2(s) + 4H2O(g) ΔH=-274 kJ·mol-1
则 H2O(g) ![]() H2(g)+1/2O2(g) ΔH =_________kJ·mol-1。
H2(g)+1/2O2(g) ΔH =_________kJ·mol-1。
(3)光电化学分解制氢,钛酸锶光电极:4OH--4e- ![]() O2+2H2O,则铂电极的电极反应为_______。
O2+2H2O,则铂电极的电极反应为_______。
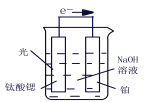
(4)水煤气法制氢。CO(g) + H2O(g) ![]() CO2(g)+ H2(g) ΔH <0,在850℃时,K=1。
CO2(g)+ H2(g) ΔH <0,在850℃时,K=1。
① 若升高温度到950℃时,达到平衡时K_________1(填“>”、“<”或 “=”)。
② 850℃时,若向一容积可变的密闭容器中同时充入1.0 mol CO、3.0 mol H2O、1.0 mol CO2 和x mol H2,若要使上述反应开始时向正反应方向进行,则x应满足的条件是_________。
(5)甲烷制氢。将1.0 mol CH4和2.0 mol H2O (g)通入容积为100 L的反应室,在一定条件下发生反应:CH4(g) + H2O (g)=CO (g) + 3H2(g)。测得达到平衡所需的时间为5 min,CH4的平衡转化率为50%,则用H2表示该反应的平均反应速率为_____。
(6)LiBH4具有非常高的储氢能力,分解时生成氢化锂和两种非金属单质。该反应的化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式的是( )
A.向澄清石灰水中通入少量SO2气体:Ca2++SO2=CaSO3↓
B.过量SO2气体通入氢氧化钠溶液中:SO2+OH-=![]()
C.SO2气体通入溴水中:SO2+Br2+H2O=2H++2Br-+![]()
D.向氢硫酸中通入氯气:S2-+Cl2=S↓+2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M可用于消毒剂、抗氧化剂、医药中间体。实验室由芳香烃A制备M的一种合成路线如下:
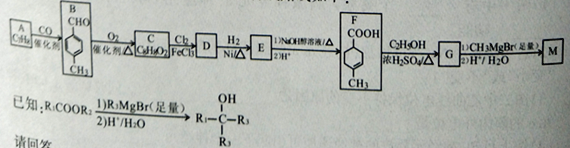
请回答:
(1)B的化学名称为___________;D中官能团的名称为______________________。
(2)由F生成G的反应类型为___________;F的分子式为___________。
(3)由E转化为F的第一步反应的化学方程式为______________________。
(4)M的结构简式为___________。
(5)芳香化合物Q为C的同分异构体,Q能发生银镜反应,其核磁共振氢谱有4组吸收峰。写出符合要求的Q的一种结构简式______________________。
(6)参照上述合成路线和信息,以苯甲酸乙酯和CH3MgBr为原料(无机试剂任选),设计制备 的合成路线_________________________________。
的合成路线_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是合成抗心律失常药物泰达隆的一种中间体,可通过以下方法合成:
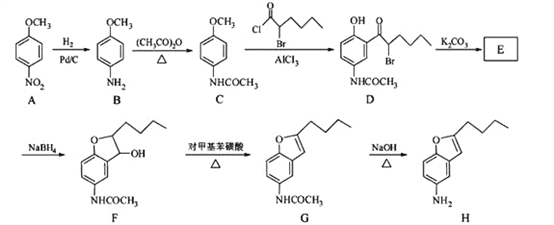
(1)D中的含氧官能团名称为________________(写两种)。
(2)F→G的反应类型为________________。
(3)写出同时满足下列条件的C的一种同分异构体的结构简式________________。
①能发生银镜反应;
②能发生水解反应,其水解产物之一能与FeCl3溶液发生显色反应;
③分子中只有4种不同化学环境的氢。
(4)E经还原得到F,E的分子是为C14H17O3N,写出E的结构简式____________。
(5)已知:①苯胺(![]() )易被氧化
)易被氧化

请以甲苯和(CH3CO)2O为原料制备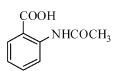 ,写出制备的合成路线流程图________。(无机试剂任用,合成路线流程图示例见本题题干)
,写出制备的合成路线流程图________。(无机试剂任用,合成路线流程图示例见本题题干)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用环己醇制备环己酮,使用的氧化剂可以是次氯酸钠、重铬酸钾等。

已知:环己醇沸点:160.8℃,微溶于水;
环己酮沸点:155.6℃,微溶于水;
醋酸沸点117.9℃,和水以任意比例互溶。
下列装置分别是产品的合成装置和精制装置示意图:

合成实验过程如下:
向装有搅拌器、滴液漏斗和温度计的三颈烧瓶中依次加入5.2mL环己醇和25mL冰醋酸。开动搅拌器,将40mL次氯酸钠溶液逐渐加入到反应瓶中,并使瓶内温度维持在30~35℃,用磁性搅拌器搅拌5min。然后,在室温下继续搅拌30min后,在合成装置中再加入30mL水、3g氯化铝和几粒沸石,加热蒸馏至馏出液无油珠滴出为止。回答下列问题:
(1)在合成装置中,甲装置的名称是_____________。
(2)三颈烧瓶的容量为_____________(填“50mL"、“100mL”或“250mL")。
(3)滴液漏斗具有特殊的结构,主要目的是_____________。
(4)蒸馏完成后,向馏出液中分批加入无水碳酸钠至反应液呈中性为止,其目的是_____________。然后加入精制食盐使之变成饱和溶液,将混合液倒入_____________中,分离得到有机层。
(5)用如图对粗产品进行精制,蒸馏收集_____________℃的馏分。
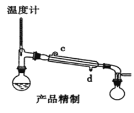
(6)检验环己酮是否纯净,可使用的试剂为_____________。
A.重铬酸钾溶液B.金属钠C.新制的氢氧化铜悬浊液D.醋酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是( )
A.铅蓄电池放电时的负极和正极的质量均增加
B.CaCO3(s)=CaO(s)+CO2(g)在室温下不能自发进行,说明该反应的△H>0
C.对于发应2H2O2![]() 2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率
2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率
D.H2O与金属Na反应生成1molH2,反应中转移的电子数为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】奥运会禁止运动员使用兴奋剂.以下两种兴奋剂的结构分别为:
①利尿酸 ②兴奋剂X
②兴奋剂X
则关于它们的说法中正确的是( )
A.利尿酸分子中有三种含氧官能团,在核磁共振氢谱中共有六个峰
B.1mol兴奋剂X与足量浓溴水反应,最多消耗4molBr2
C.两种兴奋剂均属于芳香烃
D.两种分子中的所有原子均可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解KCl和NaNO3溶液可以得到KNO3溶液,电解装置如图所示,下列说法正确的是( )

A.X为负极,F溶液为NaNO3溶液
B.电解一段时间,往Pt(I)附近滴入酚酞,溶液变红
C.电解的总反应为2H2O![]() 2H2↑ + O2↑
2H2↑ + O2↑
D.理论上,当得到0.1molKNO3时,Pt(II)上生成标准状况下1.12L气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com