
| A. | 氧化物、化合物 | B. | 非电解质、化合物 | C. | 溶液、胶体 | D. | 分散系、溶液 |
分析 A.氧化物、化合物是根据元素种类进行区别,注意它们都是纯净物;
B.水溶液中或熔融状态都不导电的化合物属于非电解质,不同元素组成的纯净物是化合物;
C.溶液、胶体是分散系,属于混合物,其本质区别在于分散质微粒直径大小;
D.溶液、胶体是分散系,属于混合物.
解答 解:A.氧化物是由两种元素组成的纯净物,其中一种元素是氧元素;化合物是由两种或两种以上的元素组成的纯净物,所以,氧化物属于化合物,后者包含前者,故A错误;
B.非电解质和化合物存在从属关系,化合物包含非电解质,不符合前者包括后者,故B错误;
C.当分散剂是水或其它溶液时,根据分散质微粒直径大小来分类,把分散系划分为:溶液(小于1nm)、胶体(1nm~100nm)、浊液(大于100nm),溶液、胶体是并列关系,不存在包含,故C错误;
D.由C分析可知,分散系包含溶液,故D正确.
故选D.
点评 本题意在考查学生对基本概念理解,首先知道各概念的定义,根据各概念之间的关系即可判断.熟悉各概念的定义是解本题的关键,然后根据各概念找出它们的关系.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源:2016-2017学年吉林省长春市高一上学期期初考试化学试卷 题型:实验题
如下图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是。
A.溶液中HCl的物质的量
B.溶液的浓度
C.溶液中Cl-的数目
D.溶液的密度
(3)某学生用上述浓盐酸和蒸馏水配制480mL物质的量浓度为0.400mol·L-1的稀盐酸。
①该学生需要用量筒量取________mL浓盐酸进行配制。
②实验所用仪器除了烧杯、玻璃棒、量筒还需要用到的玻璃仪器有
③在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填A表示“偏大”、填B表示“偏小”、填C表示“无影响”)。
a.用量筒量取浓盐酸时俯视观察凹液面
B.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
(4)①假设该同学成功配制了0.400mol·L-1的盐酸,他又用该盐酸中和含0.4gNaOH的NaOH溶液,则该同学需取________mL盐酸。(精确到小数点后一位)
②假设该同学用新配制的盐酸中和含0.4gNaOH的NaOH溶液,发现比①中所求体积偏小,则可能的原因 是________。
是________。
A.浓盐酸挥发,浓度不足
B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线
D.加水时超过刻度线,用胶头滴管吸出
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林省长春市高二上学期期初考试化学试卷 题型:选择题
下列表示对应化学反应的离子方程式正确的是
A.用KIO3氧化酸性溶液中的KI:5I-+IO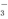 +3H2O=3I2+6OH-
+3H2O=3I2+6OH-
B.向NH4HCO3溶液中加过量的NaOH溶液并加热:NH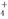 +OH-?NH3↑+H2O
+OH-?NH3↑+H2O
C.将过量SO2通入冷氨水中:SO2+NH3·H2O=HSO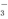 +NH
+NH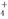
D.用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO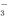 =Ag++NO↑+H2O
=Ag++NO↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
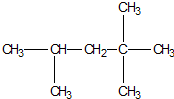 作为汽车动力燃料的汽油,其主要成份是异辛烷,其结构简式如图下列各式可以肯定与上述异辛烷互称为同系物的是( )
作为汽车动力燃料的汽油,其主要成份是异辛烷,其结构简式如图下列各式可以肯定与上述异辛烷互称为同系物的是( )| A. | C2H4 | B. | C8H18 | C. | C7H16 | D. | C6H12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | MgCl2 | Mg(OH)2 | MgCO3 |
| 溶解度(g/100g) | 74 | 0.00084 | 0.01 |
| A. | 已知MgCO3的K=6.82×10-6moL-2•L-2则所含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)•c(CO32-)=6.82×10-6moL2-•L-2 | |
| B. | 将表中三种物质与水混合,加热、灼烧,最终的固体产物相同 | |
| C. | 除去粗盐中含有的MgCl2杂质,最佳除杂试剂为Na2CO3 | |
| D. | 用石灰水处理含有Mg2+和HCO3的硬水,发生的离子反应的方程式为Mg2++2HCO3+Ca2+2OH═CaCO3↓+MgCO3↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
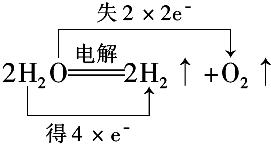 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸的脱水性属物理性质,相应的变化过程是物理变化 | |
| B. | 蓝色石蕊试纸遇浓硫酸先变红后变黑 | |
| C. | 浓硫酸可吸收SO3 | |
| D. | CuSO4•5H2O晶体投入到浓硫酸中,固体颜色由蓝变白 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①⑤ | C. | ③ | D. | ② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com