
 综合利用CO2、CO对构建低碳社会有重要意义.
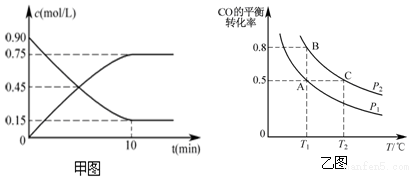
综合利用CO2、CO对构建低碳社会有重要意义.分析 (1)10min后达到平衡,测得含有0.4mol CH3OH(g),则
CO(g)+2H2(g)?CH3OH(g)
开始 1.2 1 0
转化 0.4 0.8 0.4
平衡 0.8 0.2 0.4
①结合c=$\frac{n}{V}$计算;
②结合v=$\frac{△c}{△t}$计算;
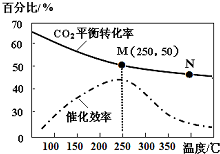
(2)①a.温度越高,反应速率越大;
b.温度在约250℃时,催化剂的催化效率对应转化率最大;
c.转化率越大,乙烯的产量越大;
②图中M点时,转化率为50%,在密闭容器中充入体积比为 3:1的 H2和CO2,则
6H2+2CO2$\stackrel{催化剂}{?}$ CH2═CH2+4H2O
开始 3n n 0 0
转化 1.5n 0.5n 0.25n n
平衡 1.5n 0.5n 0.25n n
产物CH2═CH2的体积分数为$\frac{0.25n}{1.5n+0.5n+0.25n+n}$×100%.
解答 解:(1)10min后达到平衡,测得含有0.4mol CH3OH(g),则
CO(g)+2H2(g)?CH3OH(g)
开始 1.2 1 0
转化 0.4 0.8 0.4
平衡 0.8 0.2 0.4
①10min后达到平衡时CO的浓度为c=$\frac{n}{V}$=$\frac{0.8mol}{2L}$=0.4mol/L,故答案为:0.4mol/L;
②10min内用H2表示的平均反应速率为$\frac{\frac{0.8mol}{2L}}{10min}$=0.04mol/(L.min),故答案为:0.04mol/(L.min);
(2)①a.温度越高,反应速率越大,但M、N点温度、催化剂均不同,则N点速率不最大,故错误;
b.温度在约250℃时,催化剂的催化效率对应转化率最大,则催化剂的催化效率最高,故正确;
c.转化率越大,乙烯的产量越大,则相同条件下,乙烯的产量M点比N高,故正确;
故答案为:a;
②图中M点时,转化率为50%,在密闭容器中充入体积比为 3:1的 H2和CO2,则
6H2+2CO2$\stackrel{催化剂}{?}$ CH2═CH2+4H2O
开始 3n n 0 0
转化 1.5n 0.5n 0.25n n
平衡 1.5n 0.5n 0.25n n
产物CH2═CH2的体积分数为$\frac{0.25n}{1.5n+0.5n+0.25n+n}$×100%=7.7% 或0.077,
故答案为:7.7% 或0.077.
点评 本题考查化学平衡的计算,为高频考点,把握图象分析、平衡三段法、速率及体积分数计算为解答的关键,侧重分析与计算能力的考查,注意图中影响反应速率的因素,题目难度中等.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 1000 | 1115 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com