
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是分析化学中的重要试剂,在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在500℃时隔绝空气加热A中的硫酸亚铁铵至分解完全,确定分解产物的成分。

(1)B装置的作用是_________________________________________。
(2)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定产物中一定有____________气体产生,写出D中发生反应的离子方程式______________________。若去掉C,能否得出同样结论____________(填“是”或“否”) ,原因是____________________________。
(3)A中固体完全分解后变为红棕色粉末,某同学设计实验验证固体残留物仅为Fe2O3,而不含FeO,请帮他完成表中内容。(试剂,仪器和用品自选)
实验步骤 | 预期现象 | 结论 |
___________________________ | ________________________ | 固体残留物仅为Fe2O3 |
(4)若E中收集到的气体只有N2,其物质的量为xmol,固体残留物Fe2O3的物质的量为ymol,D中沉淀物质的量为zmol,则x、y和z应满足的关系为________________________。
(5)结合上述实验现象,完成硫酸亚铁铵在500℃时隔绝空气加热完全分解的化学方程式_______________。
【答案】 检验产物中是否有水生成 SO2 SO2+H2O2+Ba2+=BaSO4↓+2H+ 否 若有SO3也有白色沉淀生成 步骤:取少量A中残留物于试管中,加入适量稀硫酸,充分振荡使其完全溶解;将溶液分成两份,分别滴加高锰酸钾溶液、KSCN溶液(或:依次滴加K3Fe(CN)6溶液、KSCN溶液或其他合理答案) 现象:若高锰酸钾溶液不褪色,加入KSCN溶液后变红(或:加入K3Fe(CN)6溶液无现象,加入KSCN溶液后变红,或其他合理答案) 3x+y=z 2(NH4)2Fe(SO4)2![]() Fe2O3+2 NH3↑+N2↑+4SO2↑+5H2O
Fe2O3+2 NH3↑+N2↑+4SO2↑+5H2O
【解析】(1)B装置中硫酸铜粉末的作用是检验产物中是否有水生成;
(2)装置C中BaC12溶液的作用是为了检验分解产物中是否有SO3气体生成,若含有该气体,会生成硫酸钡白色沉淀,观察到的观象为溶液变浑浊;现C中无明显现象,说明不含有SO3气体,再结合观察到D中有白色沉淀生成,说明含有SO2气体;装置D中通入二氧化硫和过氧化氢发生氧化还原反应,生成硫酸和氯化钡反应生成硫酸钡沉淀,反应的离子方程式为:SO2+H2O2+Ba2+=BaSO4↓+2H+;若去掉C,不能得出相同的结构,原因是无法排除SO3的干扰,因若有SO3也有白色沉淀生成;
(3)根据亚铁离子的还原性,可以用高锰酸钾溶液检验,方法为:取少量A中残留物与试管中,加入适量稀硫酸,充分振荡使其完全溶解,在所得溶液中滴加高锰酸钾溶液,并振荡,若高锰酸钾溶液褪色,则残留物中含有FeO;若高锰酸钾溶液不褪色,则残留物中不含FeO;
(4)若E中收集到的气体只有N2,其物质的量为xmol,固体残留物Fe2O3的物质的量为ymol,D中沉淀物质的量为zmol,其中N2和Fe2O3均为氧化产物,而SO2为还原产物,根据电子守恒规律,可知2×3xmol+2ymol=2Zmol,即3x+y=z;
(5)综合实验现象并结合电子守恒和原子守恒,硫酸亚铁铵在500℃时隔绝空气加热完全分解的化学方程式为2(NH4)2Fe(SO4)2![]() Fe2O3+2 NH3↑+N2↑+4SO2↑+5H2O。
Fe2O3+2 NH3↑+N2↑+4SO2↑+5H2O。


科目:高中化学 来源: 题型:
【题目】一化学兴趣小组测得某品牌漂白粉〔CaCl2与Ca(ClO)2的混合物〕中Ca元素的质量分数为32.0%,则氧元素的质量分数为( )
A.56.8%B.36.4%C.11.2%D.45.6%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“价——类”二维图是学习元素化合物知识的好方法,依据图中氮元素及其化合物的转化关系,回答问题:

(1)图中,X的化学式为_____,从N元素的化合价看,X具有_____性(“氧化”、“还原”)。
(2)回答下列关于NH3的问题:
①实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为______。
②下列试剂不能用于干燥NH3的是______(填字母)。
A.浓硫酸 B.碱石灰 C.NaOH固体
③请写出NH3→NO的化学方程式_____________ 。
④工业生产中利用氨水吸收SO2和NO2,原理如下图所示:

请写出反应2中NO2被吸收过程的化学反应程式是_____。
(3)SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。SCR(选择性催化还原)工作原理:

①已知尿素[CO(NH2)2]水溶液热分解为NH3和CO2,请写出SCR催化反应器中NH3还原NO2的化学方程式:_________。
②尿素溶液浓度影响NO2的转化,测定溶液中尿素(M=60g·mol 1)含量的方法如下:取ag尿素溶液,将所含氮完全转化为NH3,所得NH3用过量的v1mLc1mol·L1 H2SO4溶液吸收完全,剩余H2SO4用v2mLc2mol·L1 NaOH溶液恰好中和,则尿素溶液中溶质的质量分数是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在常温下一定能大量共存的是( )
A. Na2S溶液中:SO![]() 、K+、Cl-、Cu2+
、K+、Cl-、Cu2+
B. 在c(H+)/c(OH-)=1012的溶液中:NH![]() 、NO
、NO![]() 、K+、Cl-
、K+、Cl-
C. 加入铝粉能放出H2的溶液中:Mg2+、NH![]() 、NO
、NO![]() 、Cl-
、Cl-
D. 通入大量CO2的溶液中:Na+、ClO-、CH3COO-、HCO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫的催化氧化原理为2SO2(g)+O2(g)![]() 2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如下图所示。下列说法错误的是 ( )
2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如下图所示。下列说法错误的是 ( )

A. 在D点时v 正<v逆
B. 反应2SO2(g)+O2(g)![]() 2SO3(g)为放热反应
2SO3(g)为放热反应
C. 若B、C点的反应速率分别为vB、vC,则vB<vC
D. 恒温恒压下向平衡体系中通入氦气,平衡向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的分类正确的是
A.混合物:空气、有色玻璃、水银
B.碱:Ba(OH)2、Cu2(OH)2CO3、NH3·H2O
C.盐:醋酸钠、氯化铵、纯碱
D.氧化物:H2O、CO、HCOOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝广泛应用于电子陶瓷等工业领域。在一定条件下,AlN可通过以下反应合成:Al2O3+N2+3C![]() 2AlN+3CO。有关该反应下列叙述正确的是
2AlN+3CO。有关该反应下列叙述正确的是
A. 上述反应中,N2是还原剂,Al2O3是氧化剂
B. 上述反应中,每生成1 mol AlN需转移3 mol电子
C. AlN中氮的化合价为+3
D. AlN的摩尔质量为41 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列实验装置图中所示的实验操作评价合理的是
A. 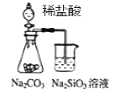 可能证明非金属性强弱:Cl>C>Si
可能证明非金属性强弱:Cl>C>Si
B. 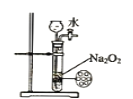 装置可用来制备少量氧气,并且控制反应的发生与停止
装置可用来制备少量氧气,并且控制反应的发生与停止
C. 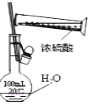 配制一定物质的量浓度的硫酸溶液不能直接在容量瓶中进行
配制一定物质的量浓度的硫酸溶液不能直接在容量瓶中进行
D. 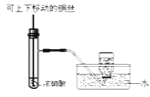 制备并收集少量NO2气体
制备并收集少量NO2气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com