
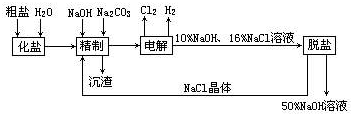
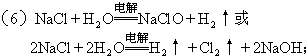 .
. 分析 由流程可知,粗盐加水化盐溶解后,加NaOH除去镁离子,加碳酸钠除去钙离子,精制后得到的沉渣为CaCO3、Mg(OH)2;精制后的食盐水电解生成NaOH、氢气、氯气,最后脱盐(NaCl等)得到高浓度的NaOH溶液,
(1)电解氯化钠溶液时,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,同时阴极附近生成氢氧化钠;
(2)用可溶性的碳酸钠除去钙离子,用NaOH除去镁离子;
(3)添加钡试剂除去SO42-,注意不能引入新的杂质;
(4)有效除去Ca2+、Mg2+、SO42-,应注意碳酸钠在钡试剂之后.
(5)根据氯化钠的溶解度随温度变化不大的特征进行分析;
(6)根据反应物和生成物写出反应方程式.
解答 解:(1)电解食盐水,与正极相连为阳极,生成氯气,该电极反应为2Cl--2e-═Cl2↑,与电源负极相连为阴极,生成氢气和NaOH,生成碱,所以pH升高,
故答案为:2Cl--2e-═Cl2↑;升高;
(2)Ca2+、Mg2+等杂质与碳酸钠、NaOH反应转化为沉淀,离子反应分别为Ca2++CO32-═CaCO3↓、Mg2++2OH-═Mg(OH)2↓,
故答案为:Ca2++CO32-═CaCO3↓、Mg2++2OH-═Mg(OH)2↓;
(3)有效除去Ca2+、Mg2+、SO42-,应注意碳酸钠在钡试剂之后,是为除去过量的钡离子,显然选项bc符合,故答案为:bc;
(4)添加钡试剂除去SO42-,注意不能引入新的杂质,选Ba(NO3)2会引入杂质硝酸根离子,所以选ac,故答案为:ac;
(5)因为氯化钠的溶解度随着温度变化不大,所以可以采用蒸发溶剂结晶的方法,然后过滤制得晶体,从而除去氢氧化钠中的氯化钠,故答案为:蒸发;过滤;
(6)若氯气和氢氧化钠充分接触,产物仅是次氯酸钠和氢气,则发生的反应为 NaCl+H2O$\frac{\underline{\;电解\;}}{\;}$NaClO+H2↑,
故答案为:NaCl+H2O$\frac{\underline{\;电解\;}}{\;}$NaClO+H2↑.
点评 本题考查粗盐提纯及电解原理,明确发生的离子反应及电解反应是解答的关键,注意除杂不能引入新的杂质及试剂的添加顺序,题目难度中等.


 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:解答题
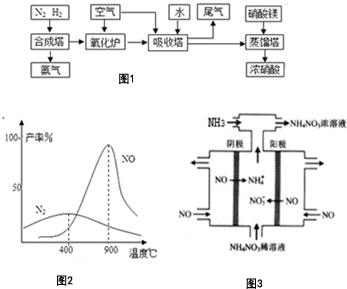 氨、硝酸、硝酸铵、硝酸铜是重要的化工产品.工业合成氨与制备硝酸一般可连续生产,流程如图1:请回答下列问题
氨、硝酸、硝酸铵、硝酸铜是重要的化工产品.工业合成氨与制备硝酸一般可连续生产,流程如图1:请回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:解答题
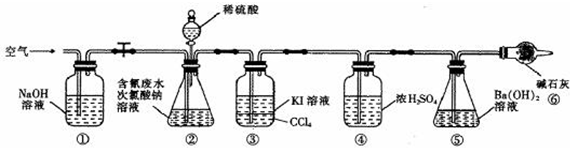
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 ( 25℃) | Ki=1.77×10-4 | Ki=5.0×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 联合制碱法中循环使用CO2和NH3,以提高原料利用率 | |
| B. | 硫酸工业中,SO2氧化为SO3时采用常压,因为高压会降低SO2转化率 | |
| C. | 合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 | |
| D. | 炼钢是在高温下利用氧化剂把生铁中过多的碳和其他杂质氧化成气体或炉渣除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠是一种灰黑色、具有金属光泽、质地软的金属 | |
| B. | 氧化钠与过氧化钠的颜色不同 | |
| C. | 因为钠的性质非常活泼,故自然界中无游离态钠 | |
| D. | 过氧化钠可以做潜艇的供氧剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
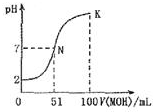 常温下,向100mL0.01mol•L-1 HA溶液中逐滴加入0.02mol-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况体积变化忽略不计).下列说法中不正确的是
常温下,向100mL0.01mol•L-1 HA溶液中逐滴加入0.02mol-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况体积变化忽略不计).下列说法中不正确的是| A. | MOH为一元弱碱 | |
| B. | MA 稀溶液PH<7 | |
| C. | N点水的电离程度大于K点水的电离程度 | |
| D. | K点对应的溶液的PH=10,则C(MOH)+C(OH)-C(H+=0.01mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com