
许多金属及它们的化合物在科学研究和工业生产中具有许多用途。
回答下列有关问题:
(1)基态Ni的核外电子排布式为__________________________________________,
第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是________。
(2)配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=________,CO与N2结构相似,CO分子内σ键与π键个数之比为________。
(3)NiO、FeO的晶体结构类型均与氯化钠的相同。
①Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO________FeO(填“<”或“>”);
②NiO晶体中Ni的配位数为________。
(4)金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是________________________________________________________________________________________________________________________________________________,
反应的离子方程式为________________________________________________________________________。
(5)一种铜金合金晶体具有面心立方最密堆积的结构。在晶胞中,Au原子位于顶点,Cu原子位于面心,则该合金中Au原子与Cu原子个数之比为________,若该晶胞的边长为a pm,则合金的密度为________g·cm-3(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
(1)1s22s22p63s23p63d84s2 C(碳)
(2)4 1∶2
(3)①> ②6
(4)H2O2为氧化剂,氨与Cu2+形成配离子,两者相互促进使反应进行 Cu+H2O2+4NH3=Cu(NH3)42++2OH-
(5)1∶3 
【解析】(1)Ni基态原子中未成对电子数为2,与之未成对电子数相同的第二周期元素为碳元素和氧元素,电负性最小的为碳元素。(2)Ni原子价电子数为10,配体CO可以提供一个孤电子对,则n= =4;氮氮三键中含有1个σ 键和2个π键,CO与N2结构相似,故CO分子内σ键与π键个数之比为1∶2。(3)①离子晶体中,在其他因素一样时,离子半径越小,离子键就越强,熔点越高;②NiO的晶体结构类型与氯化钠的相同,均为立方最密堆积,Ni原子与O原子的配位数均为6。(4)H2O2具有强氧化性,可以将Cu氧化为Cu2+,但反应速率很小,而氨与Cu2+形成配离子,两个反应相互促进使反应速率加快,反应得以进行。(5)Au原子位于顶点,则一个晶胞中含有Au原子数为8×
=4;氮氮三键中含有1个σ 键和2个π键,CO与N2结构相似,故CO分子内σ键与π键个数之比为1∶2。(3)①离子晶体中,在其他因素一样时,离子半径越小,离子键就越强,熔点越高;②NiO的晶体结构类型与氯化钠的相同,均为立方最密堆积,Ni原子与O原子的配位数均为6。(4)H2O2具有强氧化性,可以将Cu氧化为Cu2+,但反应速率很小,而氨与Cu2+形成配离子,两个反应相互促进使反应速率加快,反应得以进行。(5)Au原子位于顶点,则一个晶胞中含有Au原子数为8× =1,Cu原子位于面心,则一个晶胞中含有Cu原子数为6×
=1,Cu原子位于面心,则一个晶胞中含有Cu原子数为6× =3,故该合金中Au原子与Cu原子个数之比为1∶3;一个晶胞的质量为
=3,故该合金中Au原子与Cu原子个数之比为1∶3;一个晶胞的质量为 g,一个晶胞的体积为a3 pm3,故合金的密度为
g,一个晶胞的体积为a3 pm3,故合金的密度为 g·pm-3=
g·pm-3= g·cm-3。
g·cm-3。


科目:高中化学 来源:2014高考化学二轮复习限时集训 专题7化学反应速率和化学平衡练习卷B(解析版) 题型:填空题
(1)已知:
①Fe(s)+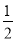 O2(g)=FeO(s) ΔH=-272.0 kJ·mol-1
O2(g)=FeO(s) ΔH=-272.0 kJ·mol-1
②2Al(s)+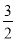 O2(g)=Al2O3(s) ΔH=-1675.7 kJ·mol-1
O2(g)=Al2O3(s) ΔH=-1675.7 kJ·mol-1
Al和FeO发生铝热反应的热化学方程式是____________________________________
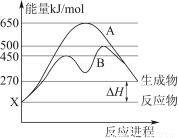
(2)某可逆反应在不同条件下的反应历程分别为A、B(如上图所示)。
①根据图判断该反应达到平衡后,其他条件不变,升高温度,反应物的转化率________(填“增大”“减小”或“不变”);
②其中B历程表明此反应采用的条件为________(选填序号)。
A.升高温度 B.增大反应物的浓度 C.降低温度 D.使用催化剂
(3)1000 ℃时,硫酸钠与氢气发生下列反应:Na2SO4(s)+4H2(g) Na2S(s)+4H2O(g)
Na2S(s)+4H2O(g)
该反应的平衡常数表达式为________________________________;
已知K1000 ℃<K1200 ℃,若降低体系温度,混合气体的平均相对分子质量将会________(填“增大”“减小”或“不变”)。
(4)常温下,如果取0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8。
①混合液中由水电离出的OH-浓度与0.1 mol·L-1 NaOH溶液中由水电离出的OH-浓度之比为________;
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH________7(填“<”“>”或“=”);相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序为(填序号)________。
a.NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题4离子反应练习卷(解析版) 题型:填空题
(1)某无色稀溶液X中,可能含有下表所列离子中的某几种。
阴离子 | CO32—、SiO32—、AlO2—、Cl- |
阳离子 | Al3+、Cu2+、Mg2+、NH4+、Na+ |
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂Y的体积(V)的关系如图所示。
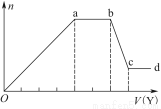
①若Y是盐酸,则溶液中含有的金属阳离子是_________________________________,
ab段发生反应的总离子方程式为___________________________________
表中Oa段与Y溶液反应的离子的物质的量之比为__________[要标明离子符号,如n(Na+)]。
②若Y是NaOH溶液,则bc段反应的离子方程式为______________________________
若不考虑离子的水解因素,忽略H+和OH-的影响,且溶液中只存在4种离子,则它们的离子个数比为___________________________________[按阳离子在前,阴离子在后,高价在前,低价在后的顺序排列]。
(2)锡为第ⅣA族元素,锡的单质和化合物与某些物质的化学性质上有许多相似之处。已知锡元素具有如下性质:
Sn4++Sn=2Sn2+;
2Sn2++O2+4H+=2Sn4++2H2O;
2H++SnO22— Sn(OH)2
Sn(OH)2 Sn2++2OH-。
Sn2++2OH-。
试回答:
①锡溶于盐酸,再向反应后的溶液中通入氯气,有关反应类似于铁的相应变化,试写出有关反应的离子方程式:______________________________________,
②将①中溶液蒸干后继续加热所得固体,变化过程类似于FeCl3溶液相应的变化,则最后得到的固体物质是(分子式)__________。
③若可用SnCl2溶液与过量的碱溶液反应的方法制Sn(OH)2, 该碱是__________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题17有机化学基础练习卷(解析版) 题型:填空题
呋喃酚是合成农药的重要中间体,其合成路线如下:

(1)A物质核磁共振氢谱共有 个峰,B→C的反应类型是 ,E中含有的官能团名称是 ,D不能够发生的反应有 (填代号)。
①氧化反应 ②取代反应 ③加成还原 ④消去反应
(2)已知X的分子式为C4H7Cl,写出A→B的化学方程式: 。
(3)Y是X的同分异构体,分子中无支链且不含甲基,则Y的名称(系统命名)是 。
(4)下列有关化合物C、D的说法正确的是 。
①可用氯化铁溶液鉴别C和D
②C和D含有的官能团完全相同
③C和D互为同分异构体
④C和D均能使溴水褪色
(5)E的同分异构体很多,写出符合下列条件的芳香族同分异构体的结构简式: 。
①环上的一氯代物只有一种
②含有酯基
③能发生银镜反应
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题16物质结构与性质练习卷(解析版) 题型:填空题
ⅤA族的氮、磷、砷(As)、锑(Sb)等元素在化合物中常表现出多种氧化态,含ⅤA族元素的化合物在科研和生产中有许多重要用途。请回答下列问题:
(1)N、P、As原子的第一电离能由大到小的顺序为____________(用元素符号表示)。
(2)As原子核外M层电子的排布式为________________________________________________________________________。
(3)叠氮化钠(NaN3)用于汽车安全气囊中氮气的发生剂,写出与N3-互为等电子体的分子的化学式________(任写一种即可)。
(4)白磷(P4)的结构如图所示,P原子的轨道杂化方式是________。
(5)NO可以与许多金属离子形成配合物,例如[ Co(NO2)6]3-,它可以用来检验K+,其反应如下:3K++[Co(NO2)6]3-=K3[Co(NO2)6]↓(亮黄色)。
①NO的立体构型是________。
②在K3[Co(NO2)6]中,中心离子的配位数为________。
(6)天然氨基酸的命名常用俗名(根据来源与性质),例如,最初从蚕丝中得到的氨基酸叫丝氨酸(HOCH2CHCOOHNH2)。判断丝氨酸是否存在手性异构体?________(填“是”或“否”)。
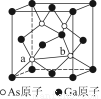
(7)砷化镓为第三代半导体,以其为材料制造的灯泡寿命长,耗能少。已知立方砷化镓晶胞的结构如图所示,其晶胞边长为c pm,则密度为________g·cm-3(用含c的式子表示,设NA为阿伏加德罗常数的值),a位置As原子与b位置As原子之间的距离为________pm(用含c的式子表示)。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题15化学与技术练习卷(解析版) 题型:填空题
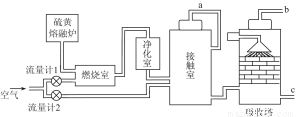
(1)火山喷发所产生的硫黄可用于生产重要的化工原料硫酸。某企业用如图所示的工艺流程生产硫酸。
请回答下列问题:
①为充分利用反应放出的热量,接触室中应安装 (填设备名称)。吸收塔中填充有许多瓷管,其作用是 。
②为使硫黄充分燃烧,经流量计1通入燃烧室的氧气过量50%。为提高SO2转化率,经流量计2的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2.5倍,则生产过程中流经流量计1和流量计2的空气体积比应为 。假设接触室中SO2的转化率为95%,b管排出的尾气中二氧化硫的体积分数为 。(空气中氧气的体积分数按0.2计),该尾气的处理方法是 _。
③与以硫铁矿为原料的生产工艺相比,该工艺的特点是 (可多选)。
A.耗氧量减少
B.二氧化硫的转化率提高
C.产生的废气减少
D.不需要使用催化剂
(2)硫酸的用途非常广泛,可应用于下列哪些方面 (可多选)。
A.橡胶的硫化
B.表面活性剂“烷基苯磺酸钠”的合成
C.铅蓄电池的生产
D.过磷酸钙的制备
(3)矿物燃料的燃烧是产生大气中SO2的主要原因之一。在燃煤中加入适量的石灰石,可有效减少煤燃烧时SO2的排放,请写出此脱硫过程中反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题14综合实验与探究练习卷B(解析版) 题型:实验题
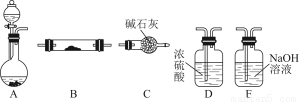
如图所示为常见气体制备、干燥、性质验证和尾气处理的部分仪器装置(加热及固定装置均略去),仪器装置可任意选择,必要时可重复选用。
请回答下列问题:
(1)在装置A的圆底烧瓶中装入锌片,分液漏斗中装入稀硫酸,以验证H2的还原性并检验其氧化产物。
①若按顺序A→D→B→B→C连接时,则两次使用的装置B中所盛放药品的化学式依次为CuO、 (填化学式)。
②检验装置的气密性后,在加热装有CuO的装置B前必须进行的操作是 。
(2)在装置A的锥形瓶中装入Na2O2,分液漏斗中装入浓氨水,装置B中装入固体催化剂,以进行氨的催化氧化。
①若装置的连接顺序为A→C→B→C,则装置B中氨的催化氧化反应的化学方程式为 ,装置B中可能观察到的现象是 。
②若把装置A制得的气体与Cl2混合在一起,产生白烟,写出反应的化学方程式 。该反应体现了氨的 性。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题13化学实验基础练习卷(解析版) 题型:选择题
下列关于除去物质中杂质的方案设计,所选除杂试剂合理的是( )
主要物质杂质除杂试剂
ASiO2Al2O3盐酸
BSiC氧气
CCO2SO2Na2CO3溶液
DCl2HClNaOH溶液
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题10非金属元素单质及化合物练习卷(解析版) 题型:填空题
实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),过程如下:

(1)将过程②中产生的气体通入下列溶液中,溶液会褪色的是________。
A.品红溶液 B.紫色石蕊溶液
C.酸性KMnO4溶液 D.溴水
(2)过程①中,FeS和O2、H2SO4反应的化学方程式为_____________________________。
(3)过程③中,需加入的物质是________。
(4)过程④中,蒸发结晶需要使用酒精灯、三脚架、泥三角,还需要的仪器有________________。
(5)过程⑤调节pH可选用下列试剂中的________(填选项序号)。
A.稀硫酸 B.CaCO3 C.NaOH溶液
(6)过程⑥中,将溶液Z加热到70~80 ℃,目的是______________________。
(7)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验。
①用分析天平称取2.700 g样品;
②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com