
【题目】已知(CH3COOH)2(g)![]() 2CH3COOH(g),经实验测得不同压强下,体系的平均摩尔质量随温度(T)的变化曲线如图所示,下列说法正确的是( )
2CH3COOH(g),经实验测得不同压强下,体系的平均摩尔质量随温度(T)的变化曲线如图所示,下列说法正确的是( )
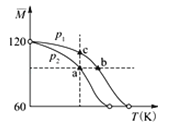
A. 该过程的△H<0
B. 气体压强:p(a)<p(b)= p(c)
C. 平衡常数:K(a)= K(b)< K(c)
D. 测定乙酸的相对分子质量要在高压、低温条件
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】常温下,向20.00mL0.1000molL-1的氨水中逐滴加入0.1000molL-1的盐酸,pH随盐酸体积的变化如图所示(不考虑NH3的逸出)。下列说法不正确的是( )
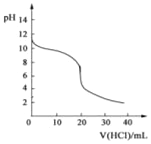
A. 反应过程中:c(NH4+)+c(H+)=c(OH-)+c(Cl-)
B. V(HCl)=10.00mL时,c(NH4+)>c(Cl-)>c(NH3H2O)
C. V(HCl)<20.00mL时,溶液一定呈碱性
D. V(HCl)=30.00mL时,2c(Cl-)=3c(NH4+)+3c(NH3H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用电解法处理含镍酸性废水并得到单质镍的原理如图所示。下列说法错误的是
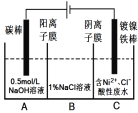
已知:①Ni2+在弱酸性溶液中发生水解;
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
A. 碳棒上发生的电极反应:4OH4e= O2↑+2H2O
B. 为了提高镍的产率,电解过程中需要控制废水的pH
C. 电解过程中,B中NaCl溶液的物质的量浓度将不断减少
D. 若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeBr2是一种黄绿色固体,某学习小组制备并探究它的还原性
Ⅰ.实验室制备FeBr2
实验室用下图所示装置制取溴化亚铁.其中A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管.e是两只耐高温的瓷皿,其中盛有细铁粉.
实验开始时先将铁粉加热至600℃~700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始,不断将d中液溴滴入100℃~120℃的D中,经过几小时的连续反应,在铁管的一端沉积有黄绿色鳞片状溴化亚铁
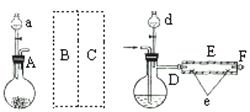
请回答:
(1)如何检查用塞子(插有导管和仪器)塞紧的D的气密性________.
(2)若在A中盛固体CaCO3,a中盛6mol/L盐酸,为使导入D中的CO2为干燥纯净的气体,则图中B、C处的装置和其中的试剂应是:B为________,C为________.为防止污染空气,实验时应在F处连接盛________的尾气吸收装置
(3)反应过程中要不断通入CO2,其主要作用是①________,②________.
Ⅱ.探究FeBr2的还原性,
(1)实验需要90 mL 0.1 mol·L-1FeBr2溶液,配制FeBr2溶液除烧杯、量筒、胶头滴管、玻璃棒外还需的玻璃仪器是________。
(2)取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+。
设计实验证明假设2是正确的_______________________________
(3)实验证明:还原性Fe2+>Br-请用一个离子方程式来证明:______________________________;
(4)若在40mL上述FeBr2溶液中通入3×10-3molCl2,则反应的离子方程式为:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100ml0.25molL﹣1 AlCl3溶液中,Cl﹣的物质的量浓度为molL﹣1;若将上述溶液加水稀释到500ml,Cl﹣的物质的量浓度为molL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明乙醇的分子组成为CH3CH2OH,而不是CH3OCH3,最充分的理由是 ( )
A. 1 mol乙醇与足量钠反应放出0.5 mol氢气
B. 1 mol乙醇完全燃烧需要3 mol氧气
C. 1 mol生成2 mol二氧化碳和3 mol水
D. 4.6 g乙醇在标准状况下的体积为2.24 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只含有Ba2+ Mg2+ Ag+三种阳离子,现用适量的NaOH溶液、稀盐酸和Na2SO4溶液将这三种离子逐一沉淀分离,其流程如图所示:
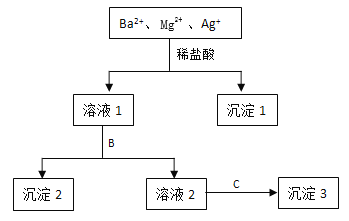
(1)沉淀1的化学式为 ,生成该沉淀的离子方程式为 。
(2)若试剂B为Na2SO4溶液,则沉淀2化学式为 。
(3)若试剂B为NaOH溶液,则生成沉淀2的离子方程式为 。
(4)如果原溶液中Ba2+ Mg2+ Ag+的浓度均为0.1 mol·L-1,且溶液中含有的阴离子只有NO3-,则溶液中NO3- 浓度为 mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,已知: CH3COOH的电离平衡常数Ka=1.8×10-5;H2SO3的电离平衡常数Kal=1.0×10-2、Ka2=1.0×10-7,回答下列问题:
(1)室温时,0.5 mol·L-1的醋酸溶液中由醋酸电离出的c(H+)约是由水电离出的c(H+)的________倍。
(2)室温时,NaHSO3的水解平衡常数Kh=________,NaHSO3溶液中的各离子浓度由大到小的顺序为________________。若向NaHSO3溶液中加入少量I2,则溶液中c(H2SO3)/c(HSO3-)将________(填“增大”、“减小”或“不变”)
(3)室温时,0.1 mol/L Na2SO3溶液的pH=________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A.78gNa2O2与足量的H2O反应,转移的电子数为2NA
B.通常条件下,28gCO和N2的混合气体中所含分子数为NA
C.标准状况下,22.4LH2O中含有的原子数为3NA
D.2mol/LCaCl2溶液中,含有Cl-个数为4NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com