
��֪����Cl2ͨ������KOH��Һ�������п�����KCl��KClO��KClO3����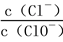 ��ֵ���¶ȸߵ��йء���n(KOH)��a mol�������й�˵���������( )
��ֵ���¶ȸߵ��йء���n(KOH)��a mol�������й�˵���������( )
A����ij�¶��£���Ӧ��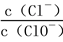 ��11������Һ��
��11������Һ�� ��
��
B���μӷ�Ӧ�����������ʵ������� a mol
a mol
C���ı��¶ȣ���Ӧ��ת�Ƶ��ӵ����ʵ���ne�ķ�Χ�� a mol��ne��
a mol��ne�� a mol
a mol
D���ı��¶ȣ�������KClO3��������۲���Ϊ a mol
a mol
 Сѧ�̲���ȫ���ϵ�д�
Сѧ�̲���ȫ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2017�����ɹŸ����ϵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪���з��ӻ����������������¶�������KI�������������±仯��
H2O2��H2O IO3����I2 MnO4����Mn2+ HNO2��NO
����ֱ��õ����ʵ�������Щ��������������KI���õ�I2�����ǣ� ��
A��H2O2 B��IO3�� [C��MnO4�� D��HNO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��ӱ�ʡ������ѧ��9���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��NAΪ�����ӵ�������ֵ������������ȷ����( )
A��һ���¶��£�15g��ȩ������Ļ������Oԭ����Ϊ0.5NA
B��pH=1��ϡ�����к��е�H+ ��Ϊ0.1NA
C��133g�Ȼ��������к��������ӵĸ���ΪNA
D���ڷ�ӦKIO3 + 6HI = KI+ 3I2 + 3H2O�У�ÿ����3mol I2ת�Ƶĵ�����Ϊ6NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�����ʡ�����и�����ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��ǿ������Һ���ܴ����������ɫ���������ǣ� ��
A��K+��Na+��NO3����MnO4�� B��K+��Na+��Cl����SO42��
C��K+��Na+��Br����Cu2+ D��Na+��Ba2+��OH����SO42��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�츣��ʡ������ٽ��Կ��Ի�ѧ�Ծ��������棩 ���ͣ�ʵ����
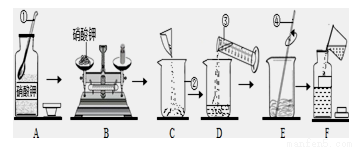
��1��д����Ţ١��ܸ����������ƣ��� ���� ���� �� �� ��
��2��A�����еĴ��� ��
��3����Ҫ����� g����Ҫˮ mL��
��4�������һ��Ҫ�������㡢 �� ���裮
��5��D�����������۵Ĺ��ӦΪ ���10m1��������50m1����500m1������
��6��E���������� ��
��7��������ȡˮʱ���Ӱ�Һ����ʹ�������������ȷ����õ��������� 5%���=��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�츣��ʡ������ٽ��Կ��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪����ʵ����ʵ��
��Cr2O3�����������KOH��Һ�õ�KCrO2��Һ��������������õ�Cr2(SO4)3��Һ��
����KCrO2��Һ�еμ�H2O2��Һ�����ữ���ɵ�K2Cr2O7��Һ��
�۽�K2Cr2O7��Һ�μӵ����ۺ�KI�Ļ����Һ�У���Һ������
�����жϲ���ȷ����( )
A��������KCrO2��CrԪ��Ϊ+3��
B��ʵ���֤��Cr2O3������������
C��ʵ���֤��H2O2�������������л�ԭ��
D��ʵ���֤�������ԣ�Cr2O72- > I2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�츣��ʡ������ٽ��Կ��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����ж���ȷ���� ( )
��ά����C���л�ԭ�ԣ�������������������
��NO2����ˮʱ����������ԭ��Ӧ
��1 mol Cl2�μӷ�Ӧת�Ƶ�����һ��Ϊ2NA
�������Ӷ�ֻ�л�ԭ��
��BaSO3��H2O2�ķ�ӦΪ������ԭ��Ӧ
A���٢ڢ� B���ڢۢ� C���ۢܢ� D���٢ܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�����ʡ�����и����ϵڶ����¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
����¡�����(2L)���ܱ������г���2 mol SO2��һ������O2��������Ӧ��2SO2(g) + O2(g) 2SO3(g) �� ��H= ��197.74 kJ��mol��1��4min��ﵽƽ�⣬��ʱc(SO2)=0.2mol��L��1����SO2��O2��ת������ȡ�����˵���У�����ȷ����
2SO3(g) �� ��H= ��197.74 kJ��mol��1��4min��ﵽƽ�⣬��ʱc(SO2)=0.2mol��L��1����SO2��O2��ת������ȡ�����˵���У�����ȷ����
A��2minʱ��c(SO2)=0.6mol��L��1
B����O2��ʾ4min�ڵķ�Ӧ����Ϊ0.1mol��(L��min)��1
C�����������г���1mol SO3���ﵽ��ƽ�⣬n(SO2)��n(O2)=2:1
D��4min���������¶ȣ�ƽ�����淽���ƶ���ƽ�ⳣ����С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�꼪��ʡ�߶���9���¿���ѧ���������棩 ���ͣ�ѡ����
��ͼ������˫Һԭ���װ�á���ͼ���ж�����˵���������

A����ͼ��ط�Ӧ�����ӷ���ʽΪCd(s)+Co2+(aq)=Co(s)+Cd2+(aq)
B��2Ag(s)+ Cd2+(aq) = Cd(s) +2Ag+(aq)��Ӧ�ܹ�����
C�����ص��������γɱպϻ�·����ʹ������Һ���ֵ�����
D����ͼ����lmol����ͨ�����·ʱ��������108��Ag����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com