
| 选项 | 实验操作 | 实验现象 | 绪论 |
| A | 向盛有Fe(NO3)2溶液的试管中加入0.1mol•L-1 H2SO4溶液 | 试管口出现红棕色气体 | 溶液NO3-被Fe2+还原为NO2 |
| B | 溴乙烷中加入氢氧化钠溶液加热充分反应后,滴入硝酸银溶液 | 产生浅黄色沉淀 | 溴乙烷中含有溴元素 |
| C | 在0.1mol•L-1 Na2CO3溶液中,加两滴酚酞显浅红色,微热 | 红色加深 | 盐类水解是吸热反应 |
| D | 向含有硫酸钡沉淀的溶液加入浓碳酸钠溶液,充分搅拌后过滤、洗涤,在滤渣中加入盐酸 | 产生无色无味气体 | Ksp(BaSO4)>Ksp(BaCO3) |
| A. | A | B. | B | C. | C | D. | D |
分析 A.稀硝酸被还原生成NO;
B.溴乙烷中加入氢氧化钠溶液加热充分反应后,滴入硝酸银溶液,因溶液呈碱性,易生成AgOH或氧化银沉淀;
C.碳酸钠水解呈碱性,加热促进水解;
D.从难溶电解质的溶解平衡的角度分析.
解答 解:A.向盛有Fe(NO3)2溶液的试管中加入0.1mol•L-1 H2SO4溶液,NO3-在酸性条件下具有氧化性,被Fe2+还原为NO,NO与氧气进一步反应生成NO2,故A错误;
B.溴乙烷中加入氢氧化钠溶液加热充分反应后,滴入硝酸银溶液,因溶液呈碱性,易生成AgOH或氧化银沉淀,不能观察到浅黄色沉淀生成,应先加入硝酸酸化,故B错误;
C.碳酸钠水解呈碱性,加入酚酞溶液变红色,加热促进水解,红色加深,故C正确;
D.常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,部分BaSO4因饱和Na2CO3溶液中高浓度CO32-转化为BaCO3,因此向洗净的沉淀中加稀盐酸,有气泡产生,但是Ksp(BaCO3)>Ksp(BaSO4),故D错误.
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质的性质、离子的检验、盐类的水解以及难容电解质的溶解平衡等,把握实验原理为解答的关键,注意方案的合理性、操作性分析,题目难度不大.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3 | B. | NH4Cl | C. | NH4NO3 | D. | (NH4)2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
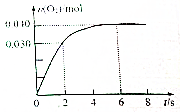 一定温度下,向2.0L恒容密闭容器中充入0.88mol NO2(g),发生反应:2NO2(g)?O2(g)+2NO(g),得到O2的物质的量随时间变化曲线如图所示,回答下列问题:
一定温度下,向2.0L恒容密闭容器中充入0.88mol NO2(g),发生反应:2NO2(g)?O2(g)+2NO(g),得到O2的物质的量随时间变化曲线如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | “地沟油”禁止食用,但可用来制肥皂 | |
| B. | 糖类、蛋白质、油脂属于天然高分子化合物 | |
| C. | 医疗中常用酒精來消毒,是因为酒精能使细菌蛋白质发生变性 | |
| D. | 氨基酸既能和强酸反应,又能和强碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
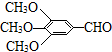 )和抗癫痫药物H(
)和抗癫痫药物H(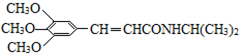 )的路线如下(部分反应略去条件和试剂):
)的路线如下(部分反应略去条件和试剂):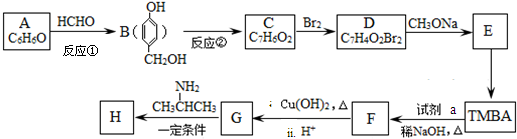
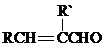 +H2O
+H2O +2Br2→
+2Br2→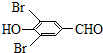 +2HBr;
+2HBr;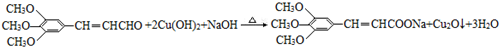 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题

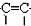 -$\stackrel{Pd}{→}$R-
-$\stackrel{Pd}{→}$R-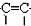 -
- ;
; ;
;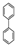 ),在一定条件下能发生银镜反应,且1molE最多可消耗4molNaOH
),在一定条件下能发生银镜反应,且1molE最多可消耗4molNaOH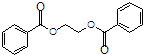 的流程,无机物任选,注明反应条件. 示例如下:A$→_{反应条件}^{反应物}$B$→_{反应条件}^{反应物}$.
的流程,无机物任选,注明反应条件. 示例如下:A$→_{反应条件}^{反应物}$B$→_{反应条件}^{反应物}$.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com