
下列说法正确的是
A.将铁粉加入FeCl3、CuCl2混合溶液中,充分反应后剩余的固体中必有铁
B.饱和FeCl3溶液在20℃时呈现棕黄色,100℃呈现红褐色,不能用平衡移动原理来解释
C.在c(H+)/c(OH-)= l012 溶液中 N a+、I-、NO3-、SO42-不能大量共存
D.在原电池装置中,电子从负极流出,沿导线流入正极,经溶液或盐桥回到负极
C
【解析】
试题分析:A、将铁粉加入FeCl3、CuCl2混合溶液中,发生的反应为:Fe + 2Fe3+ ==== 3Fe2+,Fe + Cu2+====Fe2+ + Cu,铁的还原性大于铜,充分反应后剩余的固体为铜或铁和铜的混合物,必有铜,错误;B、饱和FeCl3溶液存在铁离子的水解平衡:Fe3+ + 3H2O  Fe(OH)3 + 3H+,盐类的水解吸热,温度由20℃升高到100℃,平衡正向移动,氢氧化铁的物质的量增大,液体由黄色变为红褐色,能用平衡移动原理来解释,错误;C、在c(H+)/c(OH-)= l012 溶液呈酸性,酸性条件下H+、NO3- 和I-发生氧化还原反应,不能大量共存,正确;D、在原电池装置中,外电路中电子定向移动形成电流,电解质溶液或盐桥中阴阳离子定向移动形成电流,电子不会经过溶液或盐桥,错误。
Fe(OH)3 + 3H+,盐类的水解吸热,温度由20℃升高到100℃,平衡正向移动,氢氧化铁的物质的量增大,液体由黄色变为红褐色,能用平衡移动原理来解释,错误;C、在c(H+)/c(OH-)= l012 溶液呈酸性,酸性条件下H+、NO3- 和I-发生氧化还原反应,不能大量共存,正确;D、在原电池装置中,外电路中电子定向移动形成电流,电解质溶液或盐桥中阴阳离子定向移动形成电流,电子不会经过溶液或盐桥,错误。
考点:考查铁元素单质及其化合物的性质、盐类的水解、离子共存及原电池原理。


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源:2013-2014山西省5月月考高二化学试卷(解析版) 题型:选择题
某草药中有一种色素,它的结构简式为 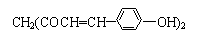 ,用它制成的试剂可以检验物质的酸碱性。能够跟1 mol该化合物起反应的Br2(水溶液)或H2的最大用量分别是
,用它制成的试剂可以检验物质的酸碱性。能够跟1 mol该化合物起反应的Br2(水溶液)或H2的最大用量分别是
A.3 mol、5 mol B.6 mol、8 mol
C.10 mol、8 mol D.6 mol、10 mol
查看答案和解析>>
科目:高中化学 来源:2013-2014山西忻州一中、长治二中、临汾一中、康杰中学高三化学(解析版) 题型:填空题
(15分)(1)已知在常温常压下:
① 2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(g) △H= -1275.6 kJ·mol-1
② H2O(l) H2O(g) △H= + 44.0 kJ.mol-1
写出表示甲醇燃烧热的热化学方程式 。
(2)甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
方法一 | CO(g) +2H2(g) |
方法二 | CO2(g) +3H2(g) |
工业上可用如下方法合成甲醇:
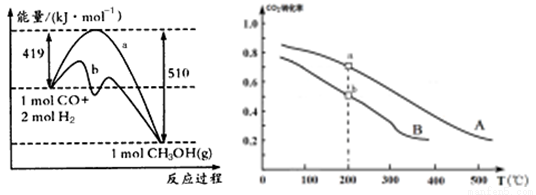
方法一 方法二
①方法一:该反应的△S 0(填“>”或“<”)。图中曲线a到曲线b的措施是
,恒温恒容时,下列说法能说明反应到达平衡状态的是 。
A.体系的平均摩尔质量不再改变 B. V(CO)= V(CH3OH)
C. H2的转化率达到了最大限度 D. △H不再改变
②方法二:将CO2和H2按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应,如图两条曲线分别表示压强为0.1 MPa和5.0 MPa下CO2转化率随温度的变化关系,其中a点的平衡常数表达式为: ;a,b两点化学反应速率别用Va、Vb表示,则Va Vb(填“大于”、“小于”或“等于”)。 已知原子利用率=期望产物的总质量与生成物的总质量之比,则方法一的原子利用率是方法二的原子利用率的 倍(保留两位小数).
(3)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是通电后将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。写出除去甲醇的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2013-2014山西大学附中高三第二学期5月理科综合化学试卷(解析版) 题型:选择题
已知:3CH4(g) + 2N2(g) 3C(s) + 4NH3(g) ΔH>0,在700℃,CH4与N2在不同物质的量之比[n(CH4)/n(N2)]时CH4的平衡转化率如下图所示:
3C(s) + 4NH3(g) ΔH>0,在700℃,CH4与N2在不同物质的量之比[n(CH4)/n(N2)]时CH4的平衡转化率如下图所示:

下列说法正确的是
A.n(CH4)/n(N2)越大,CH4的转化率越高
B.n(CH4)/n(N2)不变时,若升温,NH3的体积分数会增大
C.b点对应的平衡常数比a点的大
D.a点对应的NH3的体积分数约为26%
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省青岛市高三第二次模拟考试理综化学试卷(解析版) 题型:实验题
(12分)【化学——化学与技术】
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3,杂质为SiO2、Al2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下图。涉及的主要反应是: 6FeO·Cr2O3+24NaOH+7KClO3=12Na2CrO4+3Fe2O3+7KCl+12H2O
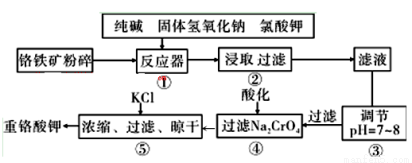
(1)碱浸前将铬铁矿粉碎的目的是 。
(2)步骤③调节pH后过滤得到的滤渣是 。
(3)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式 。
(4)用简要的文字说明操作⑤加入KC1的原因
(5)目前处理酸性Cr2O72-废水多采用铁氧磁体法。该法是向废水中加入FeSO4 ·7H2O将Cr2O72-还原成Cr3+,调节pH,Fe、Cr转化成相当于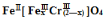 (铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr2O72-,需加入a mol FeSO4 ? 7H2O,下列结论正确的是_______。
(铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr2O72-,需加入a mol FeSO4 ? 7H2O,下列结论正确的是_______。
A.x =0.5 ,a =8 B.x =0.5 ,a = 10 C.x = 1.5 ,a =8 D.x = 1.5 ,a = 10
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省青岛市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
化学已经渗透到人类生活的各个方面,下列说法不正确的是
A.户外钢架桥生锈主要是电化学腐蚀所致
B.葡萄中的花青素在碱性环境下显蓝色,故可用苏打粉检验假葡萄酒
C.导电塑料是应用于电子工业的一种新型有机高分子化合物
D.青岛世园会喷雾风扇依据化学能与热能转化原理,会自动喷出清凉水雾
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省烟台市高三5月适应性测试一理综化学试卷(解析版) 题型:选择题
25℃时,满足c(CH3COOH)+c(CH3COO-)=0.1mol·L-1的醋酸和醋酸钠混合溶液中,c(CH3COO-)与pH的关系如图所示。下列叙述错误的是
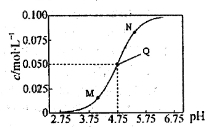
A.该温度下醋酸的电离常数Ka为l0-4.75mol·L-l
B.M点所表示的溶液中: c(Na+)+c(H+)+c(CH3COOH)=0.1 mol·L-1
C.N点所表示的溶液中:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-)
D.Q点所表示的溶液中加入等体积的0.05mol·L-1NaOH溶液充分反应后pH>7
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省潍坊市高三4月模拟考试理综化学试卷(解析版) 题型:选择题
短周期元素R、T、Q、W、G在元素周期表中的相对位置如图所示,其中Q是无机非金属材料的主角。下列判断正确的是
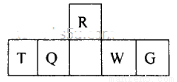
A.离子半径:T< W<G
B.等物质的量的W、G单质分别与足量铁粉反应,后者消耗的铁粉多
C.最简单气态氢化物的热稳定性:Q<R
D.T和G组成的化合物溶于水,其水溶液呈中性
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省潍坊市下学期期中考试高一化学试卷(解析版) 题型:选择题
从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平。如图表示了三种金属被人类开发利用的大致年限。之所以有先后,主要取决于

A.金属的化合价高低 B.金属的活动性大小
C.金属的导电性强弱 D.金属在地壳中的含量多少
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com