
【题目】以乙醇、浓硫酸、液溴为原料制备1,2-二溴乙烷的装置如下图所示

1,2二溴乙烷和液溴的主要物理性质如下:
物质 | 熔点/℃ | 沸点/℃ | 密度/(g·cm-3) | 溶解性 |
1,2-二溴乙烷 | 9.79 | 131.4 | 2.18 | 难溶于水,易溶于醇、醚等 |
液溴 | -7.2 | 58.78 | 3.12 | 微溶于水,能溶于醇、醚等 |
(1)装置A中反应的化学方程式是________;装置D试管中反应的化学方程是________;
(2)装置B的作用是_____,装置C的作用是____。
(3)设计实验分离出1,2-二溴乙烷的操作步骤为:a.将反应后D中试管内的液体倒入仪器甲中,然后再注入适量试剂X;b.充分振荡,静置,使其分层。
①仪器甲是______(填名称);
②试剂X是______;
A.水 B.乙醇 C.四氯化碳 D.NaOH溶液
【答案】CH3CHOH ![]() CH2=CH2↑+H2O CH2=CH2+Br2
CH2=CH2↑+H2O CH2=CH2+Br2![]() CH2BrCH2Br 防倒吸,检查实验进行中导管是否发生堵塞 吸收乙烯气体中含有的CO2、SO2等杂质气体 分液漏斗 D
CH2BrCH2Br 防倒吸,检查实验进行中导管是否发生堵塞 吸收乙烯气体中含有的CO2、SO2等杂质气体 分液漏斗 D
【解析】
乙醇在浓硫酸作催化剂,170℃时,发生消去反应得到乙烯,但还有副反应,由于浓硫酸具有强氧化性,在加热条件下,乙醇会与浓硫酸反应生成CO2和SO2,而且乙醇易挥发。C中的NaOH溶液可以吸收CO2和SO2等杂质气体;乙烯与溴单质发生加成反应生成1,2-二溴乙烷,E中的NaOH用于吸收挥发出来的Br2。
(1) 乙醇在浓硫酸作催化剂,170℃时,发生消去反应得到乙烯,化学方程式为CH3CHOH ![]() CH2=CH2↑+H2O;D中为乙烯与溴发生生成1,2-二溴乙烷,化学方程式为CH2=CH2+Br2
CH2=CH2↑+H2O;D中为乙烯与溴发生生成1,2-二溴乙烷,化学方程式为CH2=CH2+Br2![]() CH2BrCH2Br;
CH2BrCH2Br;
(2)乙醇和浓硫酸反应的产生的气体中除了乙烯,还有挥发出来的乙醇,副产物SO2等,均能溶于水,B装置可以起到发倒吸的作用,D装置中的产物1,2-二溴乙烷为油状液体,可以通过B中液面的变化判断是否发生了堵塞,答案为防倒吸,检查实验进行中导管是否发生堵塞;
C中溶液为NaOH溶液,可与副产物SO2等发生反应,答案为吸收乙烯气体中含有的CO2、SO2等杂质气体;
(3)乙烯与溴反应生成1,2-二溴乙烷为油状液体,多余的溴溶于有机物,需要进行分离,可将Br2转化为无机盐,溶于水溶液中,再与有机相进行分类;互不相溶的两种液体用分液进行分离,在分液漏斗中进行,加入能够与Br2反应的NaOH溶液将Br2转化为NaBr和NaBrO,溶于水中,所以仪器甲为分液漏斗;试剂X为NaOH溶液。


科目:高中化学 来源: 题型:
【题目】取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.2mol/L的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,下列叙述正确的是( )

A. A曲线表明原NaOH溶液中通入CO2后,所得溶液中的溶质成分是Na2CO3和NaHCO3
B. B曲线中消耗盐酸0<v(HCl)<25mL时发生的离子反应为:OH-+H+=H2O H++CO32-=HCO3-
C. B曲线表明原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气体体积(标准状况)的最大值为224mL
D. 原NaOH溶液的物质的量浓度为1.0mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年科学家提出“绿色自由”构想。把含有大量![]() 的空气吹入
的空气吹入![]() 溶液中,再把
溶液中,再把![]() 从溶液中提取出来,并使之与
从溶液中提取出来,并使之与![]() 反应生成可再生能源甲醇。其工艺流程如图所示:
反应生成可再生能源甲醇。其工艺流程如图所示:
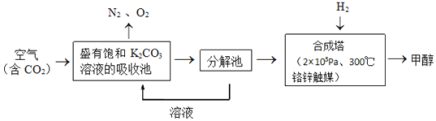
(1)分解池中主要物质是______;
(2)在合成塔中,若有![]() 与足量
与足量![]() 恰好完全反应,生成气态的水和甲醇,可放出5370kJ的热量,写出该反应的热化学方程式______;
恰好完全反应,生成气态的水和甲醇,可放出5370kJ的热量,写出该反应的热化学方程式______;
(3)该工艺在那些方面体现了“绿色自由”构想中的“绿色”______。(答二条)
(4)一定条件下,向2L恒容密闭容器中充入1mol![]() 和3mol
和3mol![]() ,在不同催化剂作用下发生反应I、反应II与反应III,相同时间内
,在不同催化剂作用下发生反应I、反应II与反应III,相同时间内![]() 的转化率随温度变化如图所示:
的转化率随温度变化如图所示:

![]() 图中c点的转化率为
图中c点的转化率为![]() ,即转化了
,即转化了![]()
①催化剂效果最佳的反应是______ (填“反应I”,“反应II”,“反应III”)。
②b点v (正)______ v (逆)(填“>”,“<”,“=”)。
③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因是______。
④c点时该反应的平衡常数K=______。
⑤一定条件下,向2L恒容密闭的上述容器中再充入1mol![]() 和3mol
和3mol![]() ,达到新的化学平衡后,
,达到新的化学平衡后,![]() 的浓度较原平衡浓度______
的浓度较原平衡浓度______![]() 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变”![]() 。
。
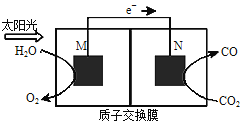
(5)科学家还研究了其它转化温室气体的方法,利用图所示装置可以将![]() 转化为气体燃料
转化为气体燃料![]() 该装置工作时,N电极的电极反应式为______。
该装置工作时,N电极的电极反应式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A(g)+ 4B(g)![]() C(g)+ D(g),在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
C(g)+ D(g),在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
A. vA=0.15mol/(L·min) B. vB=0.6 mol/(L·min)
C. vC=0.4 mol/(L·min) D. vD=0.01 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.124 g P4含有P—P键的个数为4NA
B.12 g石墨烯(单层石墨)中含有C-C键的数目为3NA
C.60gSiO2中含Si—O键的个数为2NA
D. 六方最密堆积的配位数是12,空间利用率是74%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl微溶于水,不溶于稀酸,可溶于Cl-浓度较大的体系,在潮湿的空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下:
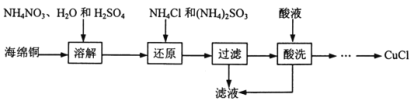
(1)基态铜原子核外电子排布式为:________。
(2)为了提高溶解速率,可以适当加热到60~70℃,还可以采用的措施为________。
(3)溶解步骤的温度控制在60~70℃,温度不宜过高的原因是________。该步骤中Cu 与NH4NO3反应的离子方程式为 (N元素被还原到最低价)_________________。
(4)还原步骤发生反应的离子方程式为______________________。
(5)滤液的主要成分为__________(写化学式)。
(6)酸洗时,可选用稀硫酸或稀盐酸,但不能用浓盐酸的原因是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
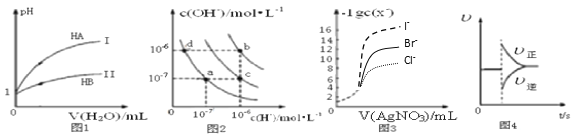
A. 图1表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则等物质的量浓度的NaA和NaB混合溶液中:c(Na+)>c(A-)>c(B-)>c(OH-)>c(H+)
B. 图2中在b点对应温度下,将pH=2的H2SO4溶液与pH=12的NaOH溶液等体积混合后,溶液显中性
C. 用0.0100 mol/L硝酸银标准溶液,滴定浓度均为0.1000 mol/L Cl-、Br-及I-的混合溶液,由图3曲线,可确定首先沉淀的是Cl-
D. 图4表示在N2(g)+3H2(g) ![]() 2NH3(g)达到平衡后,减小NH3浓度时速率的变化
2NH3(g)达到平衡后,减小NH3浓度时速率的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中,先后顺序正确的是
A.稀释浓硫酸时,先在烧杯中加入一定体积的浓硫酸,后注入蒸馏水
B.酸碱中和滴定时,锥形瓶先用标准液洗涤后,再注入待测液
C.在制取干燥纯净的氯气时,先使氯气通过饱和食盐水,后通过浓硫酸
D.为检验酸性溶液中的![]() 和
和![]() ,先加硝酸银溶液,滤去沉淀后加硝酸钡溶液
,先加硝酸银溶液,滤去沉淀后加硝酸钡溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列七种有机物中:
A.CH4 B.CH2=CH2 C.![]()
D.CH3COOH E.淀粉 F.葡萄糖 G.蛋白质
(1)酸性比碳酸强的是______(填字母编号,下同).
(2)易发生银镜反应的是______.(3)具有正四面体结构的是______.
(4)通常用于检验碘单质的是______.(5)可用于合成聚乙烯塑料的是______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com