
某实验小组对FeCl3的性质和用途展开了实验。
实验一:
实验步骤
①往锥形瓶中加入50 mL、3.0%的双氧水。
②分别往锥形瓶中加0.5 g不同的催化剂粉末,立即塞上橡皮塞。
③采集和记录数据。
④整理数据得出下表。
表:不同催化剂催化双氧水分解产生O2的压强对反应时间的斜率
| 催化剂 | 氯化铁 | 二氧化锰 | 猪肝 | 马铃薯 |
| 压强对时间的斜率 | 0.0605 | 3.8214 | 0.3981 | 0.0049 |
(1)该“实验一”的实验名称是 ;
(2)催化效果最好的催化剂是 ;
实验二:氯化铁催化分解双氧水的最佳条件
该实验小组的同学在进行实验二时,得到了如下的数据。
表:不同浓度的双氧水在不同用量的FeCl3?6H2O作用下完全反应所需时间
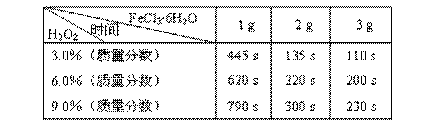
分析表中数据我们可以得出:
(3)如果从实验结果和节省药品的角度综合分析,当选用6.0%的双氧水时,加入______g FeCl3?6H2O能使实验效果最佳;
(4)进行该实验时,控制不变的因素有反应温度、 等;
(5)如图是2 gFeCl3?6H2O催化分解50 ml3.0%的双氧水时收集到的O2体积对反应时间示意图,请分别画出相同条件下1 g、3 g FeCl3?6H2O催化分解50 ml3.0%的双氧水时收集到的同温同压下O2体积对反应时间示意图,并作必要的标注;

讨论:有关FeCl3参加的可逆反应的两个问题:
(6)分别取若干毫升稀FeCl3溶液与稀KSCN
溶液混合,溶液呈血红色。限用FeCl3、KSCN、
KCl三种试剂,仪器不限,为证明FeCl3溶液与
KSCN溶液的反应是一个可逆反应,至少还要进行
次实验;
(7)一定浓度的FeCl3与KSCN两溶液反应达到平衡,在t1时刻加入一些FeCl3固体,反应重新达到平衡。若其反应过程可用如下的速率v―时间t图像表示。

请根据此图像和平衡移动规律求证新平衡下FeCl3的浓度比原平衡大
。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
(5分)某实验小组对H2O2的分解做了如下探究:
(1)下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据:
用10ml H2O2制取150ml(标准状况下)O2所需的时间(s)
| 反应条件 时间(s) 反应条件 时间(s) 浓度 |
30%H2O2 |
15%H2O2 |
10%H2O2 |
5%H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 360 | 480 | t | 720 |
| MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
①该实验小组在设计方案时,考虑了浓度、 、 等因素对H2O2分解速率的影响。
![]() ②推测t的范围为 。
②推测t的范围为 。
(2)将质量相同但聚集状态不同的MnO2分别加入15 ml 5%的H2O2溶液中,并用带火星的木条测试,结果如下:
| 催化剂(MnO2) | 操作情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 反应较慢,火星红亮但木条未复燃 | 30min |
①写出上述实验中发生反应的化学方程式:
②实验结果表明,催化剂的催化效果与 有关。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年四川成都外国语学校高一下学期期中考试化学试卷(带解析) 题型:实验题
(5分)某实验小组对H2O2的分解做了如下探究:
(1)下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据:
用10ml H2O2制取150ml(标准状况下)O2所需的时间(s)
| 反应条件 时间(s) 反应条件 时间(s) 浓度 | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 360 | 480 | t | 720 |
| MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
 ②推测t的范围为 。
②推测t的范围为 。| 催化剂(MnO2) | 操作情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 反应较慢,火星红亮但木条未复燃 | 30min |
查看答案和解析>>
科目:高中化学 来源:2014届四川成都外国语学校高一下学期期中考试化学试卷(解析版) 题型:实验题
(5分)某实验小组对H2O2的分解做了如下探究:
(1)下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据:
用10ml H2O2制取150ml(标准状况下)O2所需的时间(s)
|
反应条件 时间(s) 反应条件 时间(s) 浓度 |
30%H2O2 |
15%H2O2 |
10%H2O2 |
5%H2O2 |
|
无催化剂、不加热 |
几乎不反应 |
几乎不反应 |
几乎不反应 |
几乎不反应 |
|
无催化剂、加热 |
360 |
480 |
t |
720 |
|
MnO2催化剂、加热 |
10 |
25 |
60 |
120 |
①该实验小组在设计方案时,考虑了浓度、 、 等因素对H2O2分解速率的影响。
 ②推测t的范围为
。
②推测t的范围为
。
(2)将质量相同但聚集状态不同的MnO2分别加入15 ml 5%的H2O2溶液中,并用带火星的木条测试,结果如下:
|
催化剂(MnO2) |
操作情况 |
观察结果 |
反应完成所需的时间 |
|
粉末状 |
混合不振荡 |
剧烈反应,带火星的木条复燃 |
3.5min |
|
块状 |
反应较慢,火星红亮但木条未复燃 |
30min |
①写出上述实验中发生反应的化学方程式:
②实验结果表明,催化剂的催化效果与 有关。
查看答案和解析>>
科目:高中化学 来源:同步题 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com