
【题目】在一定条件下铁粉和水蒸气反应,可以得到铁的氧化物。实验中其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去)。根据图示判断下列说法不正确的是( )
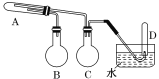
A.实验进行时试管A中应加入的试剂是铁粉
B.烧瓶B的作用是防止倒吸,烧瓶C的作用是产生水蒸气
C.试管D中收集到的是H2
D.A、B装置都需要酒精灯加热
科目:高中化学 来源: 题型:
【题目】有下列8种物质:①甲烷,②苯,③聚乙烯,④二氧化硫,⑤2-丁炔,⑥环己烷,⑦环已烯,⑧对二甲苯。其中既能使酸性![]() 溶液褪色又能与溴水反应使之褪色的是( )
溶液褪色又能与溴水反应使之褪色的是( )
A.③④⑤⑧B.④⑤⑦⑧C.③④⑤⑦⑧D.④⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化学反应因反应条件不同,可生成不同的有机产品。例如:
 (X为卤素原子)
(X为卤素原子)
苯的同系物与卤素单质混合,若在光照条件下,则苯环侧链上的氢原子被卤素原子取代;若在催化剂作用下,则苯环上的氢原子被卤素原子取代。工业上利用上述信息,按下列路线合成一种香料:
![]() A
A![]() B(一氯代物)
B(一氯代物)![]() C
C![]() D
D![]() E
E ![]()
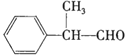 (香料)
(香料)
已知A的核磁共振氢谱上有5组峰,且峰面积之比为![]() 。请回答下列问题。
。请回答下列问题。
(1)A的结构简式为____________,E的结构简式为_____________。
(2)反应①的反应类型为_______,物质C中的官能团名称是________。
(3)反应③的反应条件是_______。
(4)反应④的化学方程式为_________(注明反应条件)。
(5)这种香料具有多种同分异构体,写出符合下列条件的同分异构体可能的结构简式:___________。
①含有酚羟基 ②分子中有苯环,且苯环上的一溴代物有两种 ③在一定条件下,自身能形成高聚物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8×10﹣5 | Ka1=4.3×10﹣7 Ka2=5.6×10﹣11 | Ka=3.0×10﹣8 |
(1)物质的量浓度均为0.1molL﹣1的四种溶液:pH由小到大排列的顺序是_______(用编号填写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)常温下,0.1molL﹣1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是_____(填字母)_______
A. c(H+) B.![]() C. c(H+)c(OH﹣) D.
C. c(H+)c(OH﹣) D. ![]() E.
E. ![]()
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:__________________
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中
c(CH3COO﹣)﹣c(Na+)=________(填准确数值)。
(5)25℃时,将a molL﹣1的醋酸与b molL﹣1氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为____________________________________
(6)标准状况下,将1.12L CO2通入100mL 1molL﹣1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式: c(OH﹣)=2c(H2CO3)+_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d、e、f为元素周期表前四周期元素,且原子序数依次增大。a原子核内无中子;在考古行业中,元素b的一种核素常用来鉴定一些文物的年代;d原子核外电子有8种不同的运动状态;e为第四周期元素,其基态原子的价电子排布式中成对电子的电子对数与单电子数相等,且每个原子轨道中都有电子;f元素的基态原子最外能层只有1个电子,且其他能层均已充满电子。回答下列问题:
(1)六种元素中电负性最大的是__(填元素符号),其中e原子的价电子排布式为__。
(2)b有多种同素异形体,其中硬度最大的是___(填名称);写出一种属于分子晶体的b的同素异形体的化学式__。
(3)a、c形成的简单分子的化学式为___,分子中c原子的杂化类型为__,分子立体构型为___。
(4)六种元素中其中有两种元素形成的化合物___(填化学式)与c的单质互为等电子体。
(5)元素d与f形成的一种化合物的晶胞结构如图所示,其中黑球在两个白球连线的中点。该化合物的化学式为__;若相邻d原子和f原子间的距离为acm,阿伏加德罗常数的值为NA,则该晶体的密度为__g·cm-3(用含a、NA的式子表示)。
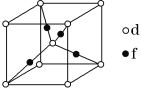
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.熔点:锂<钠<钾<铷<铯
B.由于HCl的分子间作用力比HI的强,故HC1比HI稳定
C.等质量的金刚石和石墨晶体所含碳碳键的数目相等
D.已知离子晶体AB的晶胞如图所示,则每个A+周围距离最近且等距的B-有8个
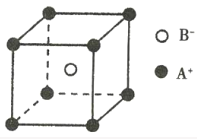
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿是主要的炼铜原料, CuFeS2是其中铜的主要存在形式。回答下列问题:
(1)CuFeS2中存在的化学键类型是_________。下列基态原子或离子的价层轨道表示式正确的是_______(填标号)。
a.Fe2+:![]() b.Cu:
b.Cu:![]()
c.Fe3+:![]() d.Cu+:
d.Cu+:![]()
(2)在较低温度下 CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体X产生。
①X分子的立体构型是________,中心原子杂化类型为______,属于________(填“非极性”或“极性”)分子。
②X的沸点比水低的主要原因是________。
(3)CuFeS2与氧气反应生成SO2。SO2中心原子的价层电子对数为_____,共价键的类型有________。
(4)四方晶系CuFeS2的晶胞结构如图所示。
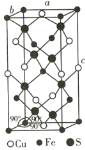
①Cu+的配位数为________,S2-的配位数为________。
②已知:a=b=0.524 nm,c=1.032 nm,NA为阿伏加德罗常数的值,CuFeS2晶体的密度是________g·cm-3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W 均为短周期元素 , 它们在周期表中相对位置如图所示。若Z原子的最外层电子数是K层电子数的3倍, 下列说法中正确的是
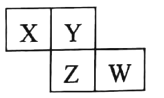
A.最高价氧化物对应水化物的酸性Z比W强
B.只由这四种元素不能组成有机化合物
C.与Z的单质相比较,Y的单质不易与氢气反应
D.X、Y形成的化合物都是无色气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能获得成功的是( )
A.将乙醛滴入银氨溶液中,加热煮沸制银镜
B.将1-氯丙烷与NaOH溶液共热几分钟后,冷却、加入过量稀硝酸酸化,滴加AgNO3溶液,得白色沉淀,证明其中含有氯元素
C.苯与浓溴水反应制取溴苯
D.![]() 溶液
溶液![]() 和
和![]() 溶液
溶液![]() 混合后加入
混合后加入![]() 的乙醛溶液
的乙醛溶液![]() ,加热煮沸观察沉淀的颜色
,加热煮沸观察沉淀的颜色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com