
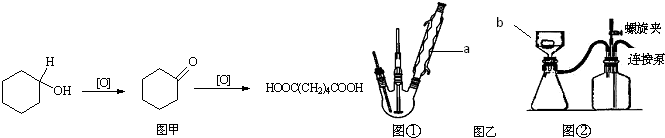
分析 根据氧化环已醇得到已二酸原理设计的实验流程图,包括制备与提纯二个部分,将液体混合物在图①反应容器中加热,得到的粗产品,再利用图②装置分离提纯得到已二酸晶体.
(1)图①装置是反应容器,加热过程中液体会挥发,发减少原料和成品的损失,用a装置达到冷凝回流的目的,图②装置是分离固体二氧化锰与混有已二酸盐的液体,将欲分离的固体、液体混合物倒进b仪器,利用液体成分在负压力作用下被抽进烧杯,固体留在上方,达到分离目的;
(2)滴加环已醇后反应中除得到已二酸盐,还生成了二氧化锰,为了使生成的二氧化锰凝聚成大颗粒方便分离,应该在沸水浴中将混合物加热几分钟;
(3)步骤3中趁热抽滤的目的是避免温度降低会有已二酸盐晶体析出,降低了产率,滤渣洗涤的目的是为了洗去二氧化锰表面附着的已二酸盐液体混合物,如果洗涤干净,最后一次洗涤液中将不再有已二酸盐,可结合已二酸盐水溶液显碱性的性质来鉴别;
(4)已二酸是一种弱酸,在步骤4中用盐酸酸化,利用复分解反应将已二酸盐转变为已二酸;
(5)为证实产品为已二酸,可根据已二酸的结构特点利用红外光谱测定产品所含有的结构特点,也可以根据已二酸的物理性质,测定熔点来鉴别.
解答 解:(1)根据装置图可知a为球形冷凝管,b为布氏漏斗,故答案为:球形冷凝管;布氏漏斗;
(2)反应进行的过程中,利用沸水浴中将混合物加热几分钟,可使生成的二氧化锰凝聚成大颗粒方便分离,故答案为:使生成的二氧化锰凝聚成大颗粒;
(3)在步骤3中通过趁热抽滤能减少已二酸盐的析出;取步骤3中的最后一次洗涤滤液,滴入酚酞,溶液不变红(无NaOH)说明已洗涤干净;故答案为:减少已二酸盐的析出;取最后一次洗涤滤液,滴入酚酞,溶液不变红说明已洗涤干净;
(4)利用强酸制弱酸的原理,在步骤4用盐酸酸化可以将已二酸盐转化为已二酸,得到产品,故答案为:将已二酸盐转变为已二酸;
(5)根据已二酸的结构特点用红外光谱来鉴别,也可以根据已二酸的物理性质,通过测产品的熔点来鉴别,故答案为:测定产品的熔点和红外光谱等.
点评 本题以醇的催化氧化为载体制备已二酸,涉及物质制备实验方案的设计及混合物分离提纯的基本操作,比较重视基础,难度不大,但错误可能会较高,通过练习可提高学生关注基础知识的学习的认识.


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:多选题
 常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol•L-1的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法正确的是( )
常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol•L-1的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法正确的是( )| A. | 原合金质量为0.92g | B. | 图中V2为60 | ||
| C. | 沉淀的质量m为1.56g | D. | OP段发生的反应为:OH-+H+═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 键,其核磁共振氢谱图显示有三重峰,峰面积之比为3:2:3,该有机物不含有CH3-O-,则A的结构简式为CH3COOCH2CH3.
键,其核磁共振氢谱图显示有三重峰,峰面积之比为3:2:3,该有机物不含有CH3-O-,则A的结构简式为CH3COOCH2CH3. 是常用香精,广泛用于食品、化妆品等行业,可从自然界中提取,也可人工合成.实验室现以食品防腐剂[主要成分为苯甲酸钠(
是常用香精,广泛用于食品、化妆品等行业,可从自然界中提取,也可人工合成.实验室现以食品防腐剂[主要成分为苯甲酸钠( )]、甲醇为原料制备苯甲酸甲酯.已知:
)]、甲醇为原料制备苯甲酸甲酯.已知:| 熔点℃ | 沸点℃ | 水溶性 | |
| 甲醇 | -97.8 | 64.7 | 易溶 |
| 苯甲酸 (一元弱酸) | 122.4 | 249.3 | 常温:0.17g 100℃:6.8g |
| 苯甲酸甲酯 | -12.3 | 198 | 难溶 |


 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 组分 | SiO2 | C | Na2O | K2O | Al2O3 | Fe2O3 |
| 质量分数 | 59.20 | 38.80 | 0.25 | 0.50 | 0.64 | 0.16 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10mol | B. | 16mol | C. | 20mol | D. | 36mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com