
| A、Na2O2 |
| B、HCl |
| C、N2 |
| D、Na2SO4 |


科目:高中化学 来源: 题型:
| A、常温常压下,11.2L Cl2中含有的分子数为0.5NA |
| B、标准状况下,11.2L H2O 中含有的分子数为0.5NA |
| C、64g SO2 中含有的原子数为3NA |
| D、0.5NA O2 物质的量为1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、自来水 |
| B、0.5mol?L-1盐酸 |
| C、0.25mol?L-1H2SO4 |
| D、0.5mol?L-1NH4NO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
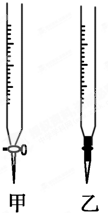 某学生用0.1000mol/L NaOH溶液滴定未知浓度的盐酸溶液,完成以下填空:
某学生用0.1000mol/L NaOH溶液滴定未知浓度的盐酸溶液,完成以下填空:| 滴定次数 | 待测液体积/mL | 标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 20 | 1.02 | 21.02 |
| 2 | 20 | 2.00 | 25.00 |
| 3 | 20 | 0.60 | 20.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用烧杯或烧瓶给液体物质加热时,要垫石棉网 |
| B、使用试纸检验溶液的性质时,应将试纸浸入溶液中 |
| C、用托盘天平称量氢氧化钠固体时,应将药品放在天平左盘的称量纸上 |
| D、如果某溶液中滴加BaCl2 溶液有白色沉淀生成,证明原溶液中一定含有SO42-离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、粉末中一定有Na2O,Na2O2,NaHCO3 |
| B、无法确定是否含有NaHCO3 |
| C、粉末中一定不含有Na2O和NaCl |
| D、无法确定是否含有Na2CO3和NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/ | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | 90 |
| 溶解度/ | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 30.5 | 27.0 |
| 析出晶体 | FeSO4?7H2O | FeSO4?4H2O | FeSO4?H2O | |||||||
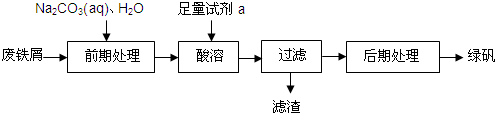
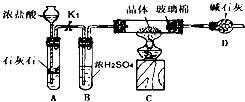
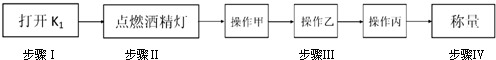
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaCl和KCl |
| B、NaCl和KCl和I2 |
| C、NaCl和KI |
| D、NaBr和KCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com