
 =0.02mol,根据硫酸根守恒可知,混合酸液中n(H2SO4)=n(BaSO4)=0.02mol,混合酸液中硫酸的物质的量浓度为
=0.02mol,根据硫酸根守恒可知,混合酸液中n(H2SO4)=n(BaSO4)=0.02mol,混合酸液中硫酸的物质的量浓度为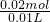 =2mol/L;
=2mol/L;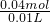 =4mol/L;
=4mol/L;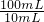 =0.4mol,n(H+)=0.08mol×
=0.4mol,n(H+)=0.08mol×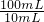 =0.8mol,加入足量的Cu,发生反应:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,硝酸全部起氧化剂作用,由方程式可知,0.4molNO3-完全反应需要H+的物质的量为0.4mol×
=0.8mol,加入足量的Cu,发生反应:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,硝酸全部起氧化剂作用,由方程式可知,0.4molNO3-完全反应需要H+的物质的量为0.4mol×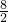 =1.6mol,大于0.8mol,故NO3-过量,根据氢离子计算生成NO,故n(NO)=0.8mol×
=1.6mol,大于0.8mol,故NO3-过量,根据氢离子计算生成NO,故n(NO)=0.8mol×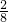 =0.2mol,NO的体积为0.2mol×22.4L/mol=4.48L,
=0.2mol,NO的体积为0.2mol×22.4L/mol=4.48L, 计算硫酸钡的物质的量,根据硫酸根守恒计算10mL混合酸液中n(H2SO4),再根据c=
计算硫酸钡的物质的量,根据硫酸根守恒计算10mL混合酸液中n(H2SO4),再根据c= 计算硫酸的物质的量浓度;
计算硫酸的物质的量浓度; 计算硝酸的物质的量浓度;
计算硝酸的物质的量浓度;

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 名称 | 性质 |
| 乙二醇 | 无色粘稠吸湿液体,易燃,沸点:196~198℃,与水混溶. |
| 丙酮 | 无色易燃液体,沸点:56.5℃,溶于水及大多数有机溶剂. |
| N,N二甲基甲酰胺(DMF) | 易燃,低毒,沸点:153℃,能与水和大多数有机溶剂混溶. |
| 对苯二甲酸(TPA) | 白色针状结晶或粉末,可燃,熔点:425℃(分解),约在300℃升华,不溶于水,微溶于热乙醇,溶于碱溶液.电离常数:Ka1=3.1×10-4,Ka2=1.5×10-5 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年福建省三明市泰宁一中高一(上)期末化学复习卷(一)(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com