
下列热化学方程式中的反应热下划线处表示燃烧热的是( )
A.NH3(g)+O2(g) NO(g)+H2O(g) ΔH=-a kJ·mol-1
NO(g)+H2O(g) ΔH=-a kJ·mol-1
B.C6H12O6(s)+6O2(g) 6CO2(g)+6H2O(l) ΔH=-b kJ·mol-1
6CO2(g)+6H2O(l) ΔH=-b kJ·mol-1
C.2CO(g)+O2(g) 2CO2(g) ΔH=-c kJ·mol-1
2CO2(g) ΔH=-c kJ·mol-1
D.CH3CH2OH(l)+O2(g) CH3CHO(l)+H2O(l) ΔH=-d kJ·mol-1
CH3CHO(l)+H2O(l) ΔH=-d kJ·mol-1
科目:高中化学 来源:2015届广东省惠州市高三第一次调研考试化学试卷(解析版) 题型:选择题
常温下,Na2CO3溶液中存在平衡:CO32-+H2O HCO3-+OH-,下列有关该溶液的说法正确的是
HCO3-+OH-,下列有关该溶液的说法正确的是
A.离子浓度:c(Na+)>c(CO32-)>c(OH-)>c(H+) B.升高温度,平衡向右移动
C.滴入CaCl2浓溶液,溶液的pH增大 D.加入NaOH固体,溶液的pH减小
查看答案和解析>>
科目:高中化学 来源:2015届安徽省高三九月份化学月考试卷(解析版) 题型:选择题
纳米材料的表面粒子数占总粒子数的比例极大,这是它具有许多特殊性质的原因。假设某氯化钠纳米颗粒的大小和形状恰好与氯化钠晶胞的大小和形状(如图所示)相同。则这种纳米颗粒的表面粒子数占总粒子数的百分数为
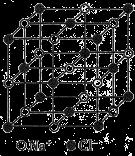
A.87.5% B.92.9% C.96.3% D.100%
查看答案和解析>>
科目:高中化学 来源:2015届安徽省同步课时练(人教选修4)1.2 燃烧热能源试卷(解析版) 题型:填空题
已知下列热化学方程式:
①CaCO3(s) CaO(s)+CO2(g) ΔH=+177.7 kJ
CaO(s)+CO2(g) ΔH=+177.7 kJ
②C(s)+H2O(g) CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
③HCl(l)+NaOH(l) NaCl(l)+H2O(l) ΔH=-57.3 kJ·mol-1
NaCl(l)+H2O(l) ΔH=-57.3 kJ·mol-1
④C(s)+O2(g) CO2(g) ΔH=-393.5 kJ·mol-1
CO2(g) ΔH=-393.5 kJ·mol-1
⑤CO(g)+O2(g) CO2(g) ΔH=-283 kJ·mol-1
CO2(g) ΔH=-283 kJ·mol-1
⑥2H2(g)+O2(g) 2H2O(l) ΔH=-571.6 kJ·mol-1
2H2O(l) ΔH=-571.6 kJ·mol-1
(1)上述热化学方程式中,不正确的有 。
(2)上述反应中,表示燃烧热的热化学方程式有 。
查看答案和解析>>
科目:高中化学 来源:2015届安徽省六校教育研究会高三第一次联考化学试卷(解析版) 题型:填空题
碳酸二甲酯(DMC)是一种近年来受到广泛关注的环保型绿色化工产品。在催化剂作用下,可由甲醇和CO2直接合成DMC:CO2+2CH3OH―→CO(OCH3)2+H2O,但甲醇转化率通常不会超过1%是制约该反应走向工业化的主要原因。某研究小组在其他条件不变的情况下,通过研究温度、反应时间、催化剂用量分别对转化数(TON)的影响来评价催化剂的催化效果。
计算公式为TON=转化的甲醇的物质的量/催化剂的物质的量。
(1)已知25 ℃时,甲醇和DMC的标准燃烧热分别为ΔH1和ΔH2,则上述反应在25 ℃时的焓变ΔH3=________。
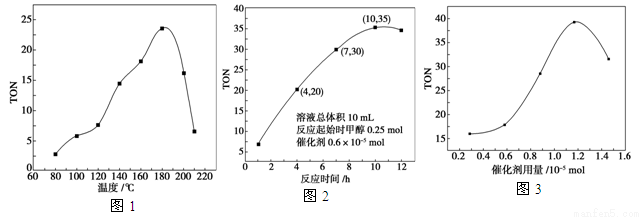
(2)根据反应温度对TON的影响图(图1)判断该反应的焓变ΔH____0(填“>”、“=”或“<”),理由是_________。
(3)根据反应时间对TON的影响图(图2),已知溶液总体积 10 mL,反应起始时甲醇0.25 mol,催化剂0.6×10-5 mol,计算该温度下,4~7 h内DMC的平均反应速率:________;计算10 h时,甲醇的转化率:________。
(4)根据该研究小组的实验及催化剂用量TON的影响图(图3),判断下列说法正确的是________。
a.由甲醇和CO2直接合成DMC,可以利用价廉易得的甲醇把影响环境的温室气体CO2转化为资源,在资源循环利用和环境保护方面都具有重要意义
b.在反应体系中添加合适的脱水剂,将提高该反应的TON
c.当催化剂用量低于1.2×10-5 mol时,随着催化剂用量的增加,甲醇的平衡转化率显著提高
d.当催化剂用量高于1.2×10-5 mol时,随着催化剂用量的增加,DMC的产率反而急剧下降
查看答案和解析>>
科目:高中化学 来源:2015届安徽省六校教育研究会高三第一次联考化学试卷(解析版) 题型:选择题
水热法制备直径为1~100 nm的颗粒Y(化合物),反应原理为:3Fe2+ + 2S2O32- + O2 + aOH-= Y+ S4O62- + 2H2O,下列说法中不正确的是
A.a=4
B.将Y均匀分散到水中形成的体系具有丁达尔效应
C.S2O32-是还原剂
D.每有3 mol Fe2+ 参加反应,反应中转移的电子总数为5 mol
查看答案和解析>>
科目:高中化学 来源:2015届安徽望江中学同步课时练(人教选修4)4.1原电池试卷(解析版) 题型:填空题
某兴趣小组为了提高电池的效率,设计了下图所示的原电池。
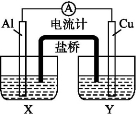
请回答下列问题:
(1)若X是AlCl3溶液,Y是稀硫酸,请你写出电极名称及电极反应:
Al片( ) , Cu片( ) 。
(2)若X是浓硝酸,Y是NaCl溶液,请你写出电极名称及电极反应:
Al片( ) , Cu片( ) 。
查看答案和解析>>
科目:高中化学 来源:2015届安徽师大附中高二下学期期中考查化学试卷(解析版) 题型:填空题
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)将水蒸气通过红热的炭即可产生水煤气。反应为:C(s)+H2O(g)  CO(g)+H2(g) ΔH=+131.3 kJ·mol-1 一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是 (填字母,下同)
CO(g)+H2(g) ΔH=+131.3 kJ·mol-1 一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是 (填字母,下同)
A.容器中的压强不变
B.1 mol H—H键断裂的同时断裂2 mol H—O键
C.v正(CO)=v逆(H2O)
D.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g)  CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实 验 组 | 温 度 /℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①该反应的逆反应为 (填“吸”或“放”)热反应。
②若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3 min,则a、b应满足的关系是 (用含a、b的数学式表示)。
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:CO2(g)+3H2(g)  CH3OH(g) +H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2, 下列措施中能使 c(CH3OH)增大的是
CH3OH(g) +H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2, 下列措施中能使 c(CH3OH)增大的是
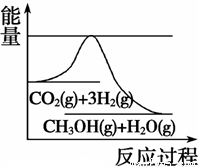
A.升高温度
B.充入N2(g),使体系压强增大
C.将H2O(g)从体系中分离出来
D.再充入0.5 mol CO2和1.5 mol H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com