
分析 (1)碳酸钠的化学式为Na2CO3,俗称为纯碱、苏打等,碳酸氢钠的化学式是NaHCO3,俗称小苏打,溶液中碳酸氢根水解程度大于其电离程度,溶液呈碱性;
(2)碳酸氢钠具有弱碱性,与HCl反应生成氯化钠、水和二氧化碳,可以治疗胃酸过多;
根据Na2CO3和NaHCO3分别与HCl反应的化学方程式即可得出产生CO2的物质的量之比;
(3)碳酸氢钠加热分解生成碳酸钠,可以用加热的方法除去碳酸钠固体中碳酸氢钠.
解答 解:(1)碳酸钠的化学式为Na2CO3,俗称为纯碱、苏打等,碳酸氢钠的化学式是NaHCO3,俗称小苏打,溶液中碳酸氢根水解程度大于其电离程度,溶液呈碱性,
故答案为:纯碱;苏打;NaHCO3;小苏打;碱;
(2)碳酸氢钠具有弱碱性,与HCl反应生成氯化钠、水和二氧化碳,反应离子方程式为HCO3-+H+=H2O+CO2↑,故可以治疗胃酸过多,NaHCO3与HCl反应的化学方程式为:NaHCO3+HCl=NaCl+H2O+CO2↑;Na2CO3与HCl反应的化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑;由以上两个化学方程式可以看出,等质量的碳酸钠和碳酸氢钠,碳酸钠物质的量小于碳酸氢钠,与足量盐酸反应时生成CO2的量,碳酸钠小于碳酸氢钠,
等物质的量的Na2CO3和NaHCO3分别与HCl反应,产生CO2的物质的量之比为1:1,
故答案为:HCO3-+H+=H2O+CO2↑;<;=;
(3)碳酸氢钠加热分解生成碳酸钠,可用加热的方法来除去碳酸氢钠,反应方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3 +CO2↑+H2O,
故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3 +CO2↑+H2O.
点评 本题主要考查了Na2CO3和NaHCO3的性质,试题内容简单,只要掌握基础知识就可完成,题目较简单.


科目:高中化学 来源: 题型:解答题
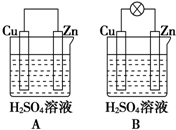 观察图A、B,回答下列问题:
观察图A、B,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇汽油是一种纯净物 | |
| B. | 乙醇汽油作燃料不会产生碳氧化物等有害气体,其优点是可以减少对环境的污染 | |
| C. | 乙醇和汽油都可作溶剂,也可相互溶解 | |
| D. | 乙醇和乙二醇互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
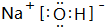 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
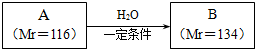
 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)=2H2O (l)△H=-571.6 kJ/mol(燃烧热) | |
| B. | NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l)△H=-57.3kJ/mol(中和热) | |
| C. | H2O (g)=H2(g)+$\frac{1}{2}$O2(g)△H=-242 kJ/mol (反应热) | |
| D. | C(s)+O2( g )=CO2(g)△H=-393.5 kJ/mol(反应热) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH相等的①NH4NO3、②(NH4)2SO4、③NH4HSO4三溶液中,c(NH4+)大小顺序为:①>②>③ | |
| B. | Na2CO3溶液中,2c(Na+)═c(CO32-)+c(HCO3-)+c(H2CO3) | |
| C. | NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7 mol/L | |
| D. | 10 mL pH=12NaOH溶液中加入pH=2的HA溶液至pH刚好等于7,则溶液体积V(总)=20 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al与稀H2SO4、稀HNO3反应均生成铝盐并放出气体,说明Al与两种酸均发生置换反应 | |
| B. | 常温下浓硫酸能使铁和铝发生钝化,于是可在常温下用铁或铝制品贮藏、贮运浓硫酸 | |
| C. | Cl2和SO2均能使品红溶液褪色,说明二者都有氧化性 | |
| D. | 向溶液中滴加硝酸酸化的BaCl2溶液出现白色沉淀,说明该溶液中一定有SO42-或SO32-中的一种或两种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
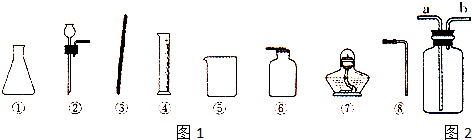
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com