
【题目】地球上海水中溴的储藏量丰富,约占地球溴总储藏量的99%,故溴有“海洋元素”之称,海水中溴含量为65 mg/L。其工业提取方法有:
(1)空气吹出纯碱吸收法。方法是将氯气通入富含溴离子的海水中,把溴置换出来,再用空气将溴吹出,用纯碱溶液吸收,最后用硫酸酸化,即可得到溴单质。该方法涉及的反应有
①______________(写出离子方程式);
②3Br2+3CO32-===![]() +5Br+3CO2;
+5Br+3CO2;
③![]() +5Br+6H+===3Br2+3H2O。
+5Br+6H+===3Br2+3H2O。
其中反应②中氧化剂是________,还原剂是________。
(2)空气吹出SO2吸收法。该方法基本同(1),只是将溴吹出后是用SO2来吸收的,使溴转化为氢溴酸,然后再用氯气氧化氢溴酸即得单质溴。写出溴与二氧化硫反应的化学方程式:_______________。
(3)溶剂萃取法。该法是利用单质溴在水中和有机溶剂中溶解度不同的原理来进行的。实验室中萃取用到的实验仪器名称是________。下列可以用于海水中溴的萃取的溶剂是_______(填序号)。
①乙醇 ②四氯化碳 ③硝酸
【答案】 Cl2+2Br=2Cl+Br2 Br2 Br2 Br2+SO2+2H2O=2HBr+H2SO4 分液漏斗 ②
【解析】
(1)①氯气有强氧化性,能氧化溴离子生成溴单质,自身被还原生成氯离子。
②针对3Br2+3CO![]() ===BrO
===BrO![]() +5Br-+3CO2↑反应中,溴的化合价由0价变为+5价和-1价,所以Br2是氧化剂发生还原反应,也是还原剂发生氧化反应,还原剂、氧化剂都为Br2。
+5Br-+3CO2↑反应中,溴的化合价由0价变为+5价和-1价,所以Br2是氧化剂发生还原反应,也是还原剂发生氧化反应,还原剂、氧化剂都为Br2。
(2)溴有氧化性,二氧化硫有还原性,在水溶液里,二氧化硫和溴发生氧化还原反应生成硫酸和氢溴酸。
(3)用于萃取实验的仪器是分液漏斗;萃取剂的选取标准是:溶质在萃取剂中的溶解度大于在水中的溶解度,萃取剂和原溶剂不互溶,萃取剂和溶质不反应,据以上分析解答。
(1)①氯气有强氧化性,能氧化溴离子生成溴单质,自身被还原生成氯离子,离子反应方程式为:Cl2+2Br-===2Cl-+Br2;正确答案:Cl2+2Br-===2Cl-+Br2。
②针对3Br2+3CO![]() ===BrO
===BrO![]() +5Br-+3CO2↑反应中,溴的化合价由0价变为+5价和-1价,所以Br2是氧化剂发生还原反应,也是还原剂发生氧化反应,还原剂、氧化剂都为Br2;正确答案:Br2;Br2。
+5Br-+3CO2↑反应中,溴的化合价由0价变为+5价和-1价,所以Br2是氧化剂发生还原反应,也是还原剂发生氧化反应,还原剂、氧化剂都为Br2;正确答案:Br2;Br2。
(2)溴有氧化性,二氧化硫有还原性,在水溶液里,二氧化硫和溴发生氧化还原反应生成硫酸和氢溴酸,反应方程式为:Br2+SO2+2H2O=2HBr+H2SO4;正确答案:Br2+SO2+2H2O=2HBr+H2SO4。
(3)用于萃取实验的仪器是分液漏斗,萃取剂的选取标准是:溶质在萃取剂中的溶解度大于在水中的溶解度,萃取剂和原溶剂不互溶,萃取剂和溶质不反应,根据萃取剂的选取标准知,乙醇、硝酸都和水互溶,所以不能作萃取剂,能作萃取剂的是四氯化碳;正确答案:分液漏斗; ②。


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】工业上电解NO制备NH4NO3,其工作原理如图所示(图中电极均为石墨电极)。下列说法错误的是

A. a 极连接电源的负极
B. 阳极反应为NO+5e-+6H+=NH4++H2O
C. 总反应方程式为8NO+7H2O![]() 3NH4NO3+2HNO3
3NH4NO3+2HNO3
D. 为使电解产物全部转化为NH4NO3,需补充物质A,A 是NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃/101kPa时,1g甲醇完全燃烧生成CO2和液态H2O,同时放出22.68kJ热量,下列表示该反应的热化学方程式正确的是( )
A.CH4O(l)+ ![]() O2(g)=CO2(g)+2H2O(g)△H=﹣725.8kJmol﹣1
O2(g)=CO2(g)+2H2O(g)△H=﹣725.8kJmol﹣1
B.2CH4O(l)+3O2(g)=2CO2(g)+2H2O(l)△H=+1451.6kJmol﹣1
C.2CH4O(l)+3O2(g)=2CO2(g)+4H2O(l)△H=﹣22.68kJmol﹣1
D.CH4O(l)+ ![]() O2(g)=CO2(g)+2H2O(l)△H=﹣725.8kJmol﹣1
O2(g)=CO2(g)+2H2O(l)△H=﹣725.8kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠、钾与水反应的实验如下图所示:

(1)钠、钾与水反应两个实验现象的相同点:
①金属________水面上;
②金属________成闪亮的小球;
③小球四处游动;
④产生嘶嘶的声音;
⑤反应后的溶液使酚酞________。
(2)_______与水反应有轻微的爆鸣声,并很快燃烧起来。
(3)实验结论:________更易与水反应,且反应更_____________________________________。
(4)钾与水反应的化学方程式是___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据化学动力学和化学热力学回答下列问题:
I.过氧化氢是一种重要的物质,在科学研究和生产生活中应用广泛。
利用H2O2和KbrO3反应研究瞬时反应速率(r),原理为在酸催化下,KBrO3+3H2O2==KBr+3O2↑+3H2O。资料显示:r=k·cx(KbrO3)·cy(H2O2),其中k为速率常数。在290K测得实验数据如下:
实验编号 | 1 | 2 | 3 | 4 |
c(H2O2)/(mol/L) | 1 | 1 | 2 | 4 |
c(KBrO3)/(mol/L) | 0.003 | 0.006 | 0.001 | 0.001 |
R/(mol·L-1·s-1) | 3×10-4 | 6×10-4 | 8×10-4 | 6.4×10-3 |
(1)写出H2O2的电子式____________,H2O2 可以看成二元弱酸,写出其第二步电离方程式_________________________________。
(2)根据表格数据信息,写出瞬时反应速率表达式r=______(k保留两位有效数字); 如果减缓反应速率,可采用的方法有___________ (任写两点)。
II.(3)25℃,101kpa时乙烯酮CH2CO(g)和甲烷CH4的燃烧热分别为:ΔH=-1025.1kJ/mol,ΔH=-890. 3kJ/mol,则反应2CH4(g)+2O2(g)![]() CH2CO(g) +3H2O(l)的热化学方程式为__________________。
CH2CO(g) +3H2O(l)的热化学方程式为__________________。
(4)在恒容容器中。通入2molCH4和2molO2,不能判断反应2CH4(g)+2O2(g)![]() CH2CO(g) +3H2O(l)处于平衡状态的是_________。
CH2CO(g) +3H2O(l)处于平衡状态的是_________。
体系内压强保持不变 B.体系内气体密度保持不变
C.单位时间每消耗2molCH4,同时生成lmolO2
D.通入等物质的量的反应物,一段时间后反应物浓度之比不变
(5)对于反应2CH4(g)+2O2(g)![]() CH2CO(g) +3H2O(g),在恒容条件下,向容器内加入0.1molCH4和0.1molO2,反应达到平衡时CH2CO的物质的量百分含量为15%,则平衡时n(CH4)=______ mol。
CH2CO(g) +3H2O(g),在恒容条件下,向容器内加入0.1molCH4和0.1molO2,反应达到平衡时CH2CO的物质的量百分含量为15%,则平衡时n(CH4)=______ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,A、F为石墨电极,B、E为铁片电极.按要求回答下列问题. 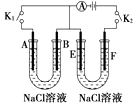
(1)打开K2 , 合并K1 . B为极,A的电极反应为 .
(2)打开K1 , 合并K2 . E为极,F极的电极反应为 , 检验F极产生气体的方法是 .
(3)若往U型管中滴加酚酞,进行(1)(2)操作时,A、B、E、F电极周围能变红的是 , 原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置处理含NO3﹣的酸性工业废水,某电极反应式为2NO3﹣+12H++10e﹣=N2+6H2O,则下列说法错误的( ) 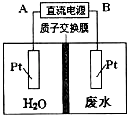
A.电源正极为A,电解过程中有气体放出
B.电解时H+从质子交换膜左侧向右侧移动
C.电解过程中,右侧电解液pH保持不变
D.电解池一侧生成5.6g N2 , 另一侧溶液质量减少l8g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com