
| A. | CaCl2溶液 | B. | Na2SiO3溶液 | C. | Ca(ClO)2的溶液 | D. | 饱和Na2CO3溶液 |
分析 先确定二氧化碳和这些溶液中的溶质是否反应,若反应,再根据反应后的生成物的溶解性确定选项.
解答 解:A、盐酸是强酸,碳酸是弱酸,所以碳酸不能制取盐酸,即二氧化碳和氯化钙不反应,最终没有沉淀析出,故A错误;
B、碳酸是弱酸,硅酸是更弱的酸,所以二氧化碳和硅酸钠能反应生成硅酸,硅酸是不溶于水的物质,所以最终有沉淀析出,故B正确;
C、次氯酸是比碳酸还弱的酸,所以二氧化碳、水和次氯酸钙反应生成碳酸钙沉淀,但二氧化碳是过量的,过量的二氧化碳和碳酸钙能继续反应生成可溶性的碳酸氢钙,所以最终没有沉淀析出,故C错误;
D、碳酸钠能和水、二氧化碳反应生成碳酸氢钠,碳酸氢钠的溶解性小于碳酸钠的溶解性,所以该溶液中会有碳酸氢钠析出,故D正确;
故选B.
点评 本题考查了碳元素及其化合物的性质,难度不大,注意次氯酸是比碳酸还弱的酸,但次氯酸是强氧化性酸.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
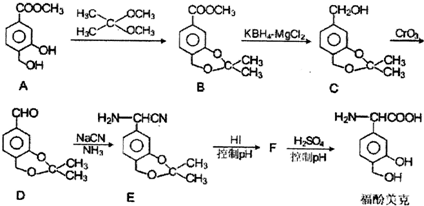
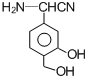 .
.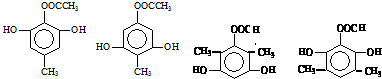 任意一种.
任意一种.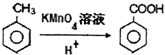 根据已有知识并结合相关信息,写出以
根据已有知识并结合相关信息,写出以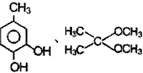 和C2H5OH为原料制备
和C2H5OH为原料制备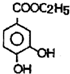 的合成路线流程图(无机试剂任用),合成路线流程图示例如图:
的合成路线流程图(无机试剂任用),合成路线流程图示例如图: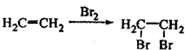
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
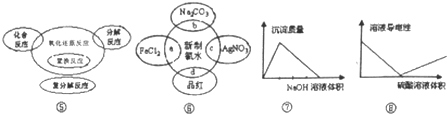
| A. | 图⑤表示四种基本反应类型与氧化还原反应的关系 | |
| B. | 图⑥表示四种物质均能与新制氯水反应,其中b能证明新制氯水具有酸性 | |
| C. | 图⑦表示AlCl3溶液中滴加NaOH溶液生成沉淀的情况 | |
| D. | 图⑧表示Ba(OH)2 溶液中滴加硫酸溶液时导电性的情况 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
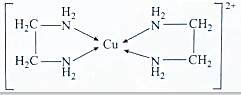
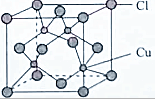
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 皂化反应是指酯在碱性条件下的水解过程 | |
| B. | 硬水使肥皂的去污能力减弱是因为发生了沉淀反应 | |
| C. | 判断油脂皂化反应是否基本完成,可通过反应后的溶液能否使红色石蕊试纸变蓝色 | |
| D. | 使高级脂肪酸从皂化反应后的混合物中析出,可用氧化钠固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷、乙烯、苯都可通过石油分馏得到 | |
| B. | 乙醇既能与有机化合物反应又能与无机化合物反应 | |
| C. | 煤焦油、石油、花生油都属于烃 | |
| D. | 鸡蛋清中加入饱和(NH4)2SO4溶液会使蛋白质失去生理活性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
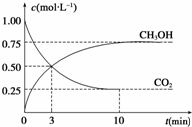 新华社2009年10月15日报道:全国农村应当在“绿色生态-美丽多彩-低碳节能-循环发展”的理念引导下,更好更快地发展“中国绿色村庄”,参与“亚太国际低碳农庄”建设.可见“低碳循环”已经引起了国民的重视,试回答下列问题:
新华社2009年10月15日报道:全国农村应当在“绿色生态-美丽多彩-低碳节能-循环发展”的理念引导下,更好更快地发展“中国绿色村庄”,参与“亚太国际低碳农庄”建设.可见“低碳循环”已经引起了国民的重视,试回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com