
| A.用托盘天平称取8 g NaOH固体(NaOH固体放置于天平的托盘上),放入250 mL烧杯中,用100 mL量筒量取100 mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解 |
| B.称取8 g NaOH固体,放入100 mL量筒中,边搅拌边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100 mL |
| C.称取8 g NaOH固体,放入100 mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀 |
| D.用100 mL量筒量取40 mL 5 mol/L NaOH溶液,倒入250 mL烧杯中,再用同一量筒量取60 mL蒸馏水,在不断搅拌下慢慢倒入烧杯中 |
科目:高中化学 来源:不详 题型:实验题
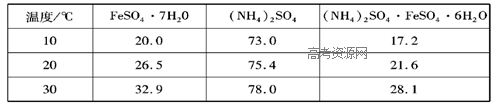
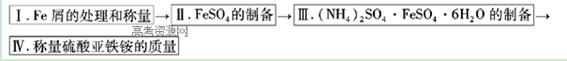
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
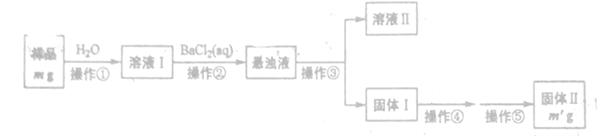
| 仪器 | 试剂 | 加入该试剂的目的 |
| A | | 鼓入空气时洗去CO2 |
| B | | 使样品充分反应放出气体 |
| C | a | |
| D | e | 充分吸收CO2 |
| E | e | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
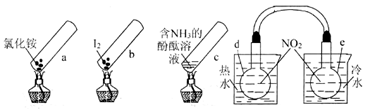
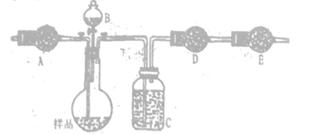
| A.加热时,a上部聚集了固体NH4Cl,说明NH4C1的热稳性比较好 |
| B.加热时,发现b中I2变为紫色蒸气,在上部又聚集为紫黑色的固体 |
| C.加热时,c中溶液红色变深,冷却后又变浅 |
| D.水浴时,d内气体颜色变浅,e内气体颜色加深 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
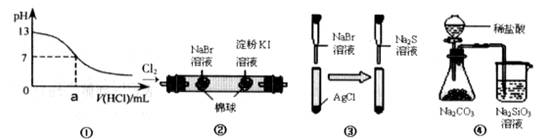
| A.①可用于表示:0.1mol·L-1的NaOH溶液滴定盐酸的滴定曲线 |
| B.②可用于证明:氧化性 Cl2>Br2>I2 |
| C.③可用于证明:Ksp(AgCl)>Ksp(AgBr)>Ksp(Ag2S) |
| D.④可用于证明:非金属性 Cl>C>Si |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com