
 三种常见短周期元素组成的化合物甲,是有机合成中的重要试剂.常温下为黄色气体,具有刺鼻恶臭味,遇水和潮气分解.标况下测定其密度为2.92g/L.浓硝酸与浓盐酸混合制王水过程中会产生少量甲气体、黄绿色气体A和水.
三种常见短周期元素组成的化合物甲,是有机合成中的重要试剂.常温下为黄色气体,具有刺鼻恶臭味,遇水和潮气分解.标况下测定其密度为2.92g/L.浓硝酸与浓盐酸混合制王水过程中会产生少量甲气体、黄绿色气体A和水. .
.分析 三种常见短周期元素组成的化合物甲,标况下测定其密度为2.97g/L.则其摩尔质量=2.92g/L×22.4L/mol=65.5g/mol,王水是浓硝酸与浓盐酸按体积比1:3混合而成的,浓硝酸与浓盐酸混合制王水过程中会产生少量甲气体、黄绿色气体A为Cl2和水,则甲为N、O、Cl组成,结合摩尔质量可知含一个氯原子,剩余为一个氧原子和一个氮原子,得到化学式为NOCl,
(1)甲中所有原子均达到8电子稳定结构,则是氮原子和氯原子形成一对公用电子对,和氧原子形成两对共用电子对,据此写出电子式;
(2)NOCl,N为正三价,具有强氧化性;
(3)浓硝酸与浓盐酸混合制王水过程中会产生少量甲气体为NOCl、黄绿色气体A为Cl2和水,依据原子守恒配平书写化学方程式;
(4)化合物甲水解生成两种酸,为非氧化还原反应,依据NOCl的结构可知和水反应生成氯化氢和亚硝酸;
(5)NO能被氧气氧化,而且属于有毒气体,会污染空气.
解答 解:(1)甲中所有原子均达到8电子稳定结构,则是氮原子和氯原子形成一对公用电子对,和氧原子形成两对共用电子对分子式为NOCl,电子式为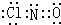 ,
,
故答案为: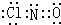 ;
;
(2)甲和一些有机物反应时需保持低温条件,常温下与有机物接触极易着火燃烧,是因为NOCl,N为正三价,具有强氧化性,易和有机物发生剧烈氧化还原反应,
故答案为:NOCl,N为正三价,具有强氧化性,易和有机物发生剧烈氧化还原反应;
(3)浓硝酸与浓盐酸混合制王水过程中会产生少量甲气体为NOCl、黄绿色气体A为Cl2和水,反应的化学方程式为;HNO3+3HCl=NOCl+Cl2↑+2H2O,
故答案为:HNO3+3HCl=NOCl+Cl2↑+2H2O
(4)甲为NOCl,水解生成两种酸,为非氧化还原反应,根据化合价可知,应生成亚硝酸和盐酸,反应的化学方程式为NOCl+H2O=HNO2+HCl,
故答案为:NOCl+H2O=HNO2+HCl;
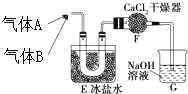
(5)NO能被氧气氧化,所以要先通氯气把装置中的氧气排净,NO属于有毒气体,会污染空气,通入足量的氯气可以使NO尽可能完全反应,避免NO逸出污染空气,
故答案为:先通氯气,驱除氧气,防止NO生成NO2,保持氯气过量,防止NO过量不能被NaOH吸收.
点评 本题考查了物质制备方案设计,题目难度中等,主要考查了化学方程式的书写、实验方案评价、氧化还原反应、环境保护等知识,侧重于考查学生的分析问题和解决问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | 哈伯法合成氨是吸热反应,新法合成氨是放热反应 | |
| B. | 新法合成和哈伯法相比不需要在高温条件下,可节约大量能源,具有发展前景 | |
| C. | 新法合成能在常温下进行是因为不需要断裂化学键 | |
| D. | 新的催化剂升高了反应所需要的能量,提高了活化分子百分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
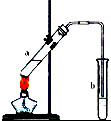 ①生成液体W的化学方程式为CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;
①生成液体W的化学方程式为CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 明矾可以作净水剂 | |
| B. | 配制硫酸铁溶液时,先把硫酸铁晶体溶解在稀硫酸中,再加水稀释至所需浓度 | |
| C. | 加热稀氨水其溶液pH稍有变化 | |
| D. | 热的纯碱溶液可以去油污 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
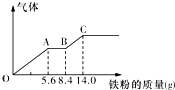 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )| A. | H2SO4浓度为2.5 mol•L-1 | |
| B. | OA段产生的是NO,AB段的反应为Fe+2Fe3+═3Fe2+,BC段产生氢气 | |
| C. | 第二份溶液中最终溶质为FeSO4 | |
| D. | 原混合酸中NO3-物质的量为0.1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
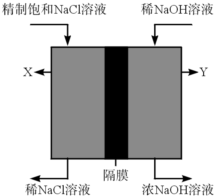 以海水为主要原料的海洋化学工业,被称为“蓝色化工”.氯碱工业是“蓝色化工”重要的组成部分,其化学反应原理是电解饱和食盐水.
以海水为主要原料的海洋化学工业,被称为“蓝色化工”.氯碱工业是“蓝色化工”重要的组成部分,其化学反应原理是电解饱和食盐水.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
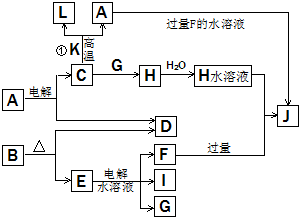 C、D、G、I均为短周期元素形成的单质,D、G、I为常见非金属气态单质.D的最外层电子数是次外层电子数的3倍,C、G同周期,且最外层电子数相差4,它们的简单离子电子层结构不同.相互间有如下转化关系:
C、D、G、I均为短周期元素形成的单质,D、G、I为常见非金属气态单质.D的最外层电子数是次外层电子数的3倍,C、G同周期,且最外层电子数相差4,它们的简单离子电子层结构不同.相互间有如下转化关系: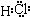 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com