
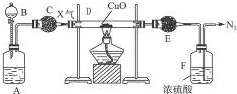
分析 (1)根据石(Al6Si2O13)中铝的质量分数的计算方法来回答;
(2)根据物质的用量和参加反应的物质来书写化学方程式;
(3)根据题意已知的反应物和生成物的量的情况确定制得Na2SiO3以及碳酸钠的量的多少;
(4)根据化学方程式进行相应的计算即可.
解答 解:(1)粉煤灰中铝的质量分数为43.4%×$\frac{27×6}{27×6+28×2+16×13}$=16.5%,故答案为:16.5;
(2)用1mol Al6Si2O13和 4mol SiO2制得5mol NaAlO2、1mol NaAlSiO4,可以得出反应的方程式为4SiO2+Al6Si2O13+8Na2CO3=5Na2SiO3+5NaAlO2+8CO2↑+NaAlSiO4,故答案为:5;8;
(3)1kg粉煤灰含莫来石(Al6Si2O13)的质量433g,其物质的量1.016mol,根据粉煤灰中Al6Si2O13与 SiO2的物质的量之比为1:2,求SiO2物质的量为2.032mol,莫来石(Al6Si2O13))生成NaAlO2用第一个方程式的计量数关系求的为4.064mol,由SiO2制的NaAlO2为2.032mol,所以可制得NaAlO25.09mol,
故答案为:5.09;
(4)设n(NaAlSiO4)=a;n(NaAlO2)=b
由Al6Si2O13+3Na2CO3=2NaAlSiO4+4NaAlO2+3CO2↑
1 3 2 4
0.5a 1.5a a 2a
再由 Al6Si2O13+5Na2CO3=2Na2SiO3 +6NaAlO2+5CO2↑
1 5 2 6
(100-0.5a) (500-2.5a) (200-a) (600-3a)
这时b=2a+(600-3a)=600-a
则x=$\frac{a}{600-a}$
a=$\frac{600x}{1+x}$,再由题意,
y=1.5a+(500-2.5a)=500-a=500-a$\frac{600x}{1+x}$,
化简得y=$\frac{500-100x}{1+x}$,
答:y与x的关系为y=$\frac{500-100x}{1+x}$.
点评 本题是一道关于金属以及化合物知识的相关计算题,考查学生分析和解决问题的能力,难度大.


科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn、FeCl2溶液、MgCl2溶液 | B. | Fe、Zn、MgCl2溶液 | ||
| C. | Mg、ZnCl2、FeSO4溶液 | D. | Fe、ZnSO4溶液、MgCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=2的溶液:Fe2+、NH4+、Cl-、NO3- | |
| B. | 能使pH试纸变深蓝色的溶液:Na+、NO3-、S2-、CO32- | |
| C. | 含有大量Fe3+的溶液:SCN-、I-、K+、Br- | |
| D. | 澄清透明的无色溶液:ClO-、MnO4-、Al3+、S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯、乙醇、乙醛 | B. | 乙炔、乙醛、乙二醇 | ||
| C. | 甲醇、甲醚、甲醛 | D. | 乙烷、甘油、乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 一溴代二甲苯 | 234℃ | 206℃ | 213.8℃ | 204℃ | 214.5℃ | 205 |
| 对应的二甲苯 | -13℃ | -54℃ | -27℃ | -54℃ | -27℃ | -54℃ |

 .
. (填任一种).
(填任一种).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 目前加碘食盐中主要添加的是KIO3 | |
| B. | 注射用的生理盐水的浓度为0.09% | |
| C. | 绿色食品是不含任何化学物质的食品 | |
| D. | 在空气质量日报中CO2含量属于空气污染指数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①②③ | C. | ①②③⑤ | D. | ①②④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com