
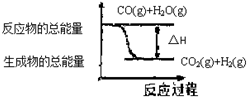
| A. | 依图象可知反应:CO(g)+H2O(g)?CO2(g)+H2(g) | |
| B. | 无法判断反应物总能量与生成物总能量的相对大小 | |
| C. | 表示此反应是吸热反应 | |
| D. | 此反应:△H>0 |
分析 化学反应的特点是有新物质生成,新物质和反应物的总能量是不同的,这是因为各物质所具有的能量是不同的;如果反应物所具有的总能量高于生成的总能量,则在反应中会有一部分能量转变为热能的形式释放,这就是放热反应,反之则是吸热反应.
解答 解:A.此图象表示的是一氧化碳与水蒸气反应生成二氧化碳和氢气,故A正确;
B.此反应反应物的能量高于生成物的总能量,故此反应放热,故B错误;
C.此反应反应物的能量高于生成物的总能量,故此反应放热,故C错误;
D.放热反应的△H<0,故D错误,故选A.
点评 本题主要考查的是能量变化规律:化学反应的本质是旧化学键的断裂和新化学键的形成,断键吸收能量,成键放出能量,所以能量变化是化学变化的基本特征之一,化学变化中的能量变化主要是由化学键变化引起的,化学反应必然伴随能量变化,能量变化的大小与反应物的质量成正比.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
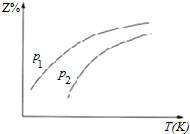
| A. | △H<0 | |
| B. | 若p1>p2,则Y一定呈气态 | |
| C. | 升高温度,该反应的化学平衡常数减小 | |
| D. | 反应处于平衡状态时,有c(X):c(2)=1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| CH4 (g) | H2O (g) | CO (g) | H2 (g) |
| 3.0mol•L-1 | 8.5mol•L-1 | 2.0mol•L-1 | 2.0mol•L-1 |
| 实验序号 | 温度/℃ | 压强/kPa | v(CH4)/mol•L-1•s-1 | v(H2O)/mol•L-1•s-1 |
| 1 | 360 | P1 | 0.100 | 0.100 |
| 2 | 480 | 101 | 0.120 | 0.120 |
| 3 | 360 | P2 | 0.080 | 0.080 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1NH4HS溶液中有:c(NH4+)=c(HS-)+c(S2-)+c(H2S) | |
| B. | 25℃时,将a mol•L-1的氨水与0.01mol•L-1的盐酸等体积混合后,c(NH4+)=c(Cl-),则NH3•H2O的电离常数为$\frac{1{0}^{-9}}{a-0.01}$ | |
| C. | 等浓度的HCN和NaCN混合溶液中有:2c(Na+)=c(CN-)+c(HCN) | |
| D. | 等pH的①(NH4)2SO4溶液 ②NH4HSO4溶液 ③NH4Cl溶液中,c(NH4+)的大小关系:①=③>② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ②⑤ | D. | ⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与盐酸反应,铁合金不与盐酸反应 | |
| B. | 一定条件下,铁粉可与水蒸气反应 | |
| C. | 不锈钢是铁合金,只含金属元素 | |
| D. | 纯铁的硬度和强度均高于铁合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 制备Al(OH)3悬浊液:向1mol•L-1AlCl3溶液中加过量的6mol•L-1NaOH溶液 | |
| B. | 提纯含有少量乙酸的乙酸乙酯:向含有少量乙酸的乙酸乙酯中加入过量15%的Na2CO3溶液,振荡后静置分液,并除去有机相的水 | |
| C. | 检验溶液中是否含有Fe2+:取少量待检验溶液,向其中加入少量新制氯水,再滴加KSCN溶液,观察实验现象 | |
| D. | 探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2mL5%H2O2和1mLH2O,向另一支试管中加入2mL5%H2O2和1mLFeCl3溶液,观察并比较实验现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
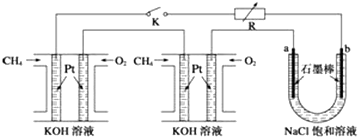
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com