下面是甲、乙、丙3位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关的实验任务
实验目的:制取乙酸乙酯
实验原理:甲、乙、丙3位同学均采取乙醇、乙酸与浓硫酸混合共热的方法制取乙酸乙酯.
装置设计:甲、乙、丙3位同学分别设计了下列3套实验装置:
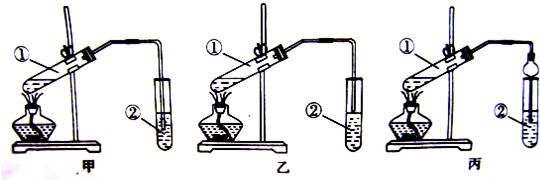
若从甲、乙两位同学设计的装置中选择1套作为实验室制取乙酸乙酯的装置,应该选择的装置是
(填“甲”或“乙”).丙同学将甲装置中的玻璃导管改成了球形干燥管,除起导气和冷凝作用外,另一个重要的作用是
.
实验步骤:
a.按所选择的装置组装仪器,在试管①中先加入3mL95%的乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2mL冰醋酸;
b.将试管固定在铁架台上;
c.在试管②中加5mL饱和Na
2CO
3溶液;
d.用酒精灯对试管①加热;
e.当观察到试管②中有明显现象停止实验.
问题讨论:
(1)步骤a中组装好实验装置后,加入样品前还应检查
.
(2)试管②中装有饱和Na
2CO
3溶液,其作用是
(填字母).
A.吸收乙醇 B.中和乙酸
C.乙酸乙酯在饱和Na
2CO
3溶液中的溶解度更小,有利于分层析出
D.加速酯的生成,提高其产率
(3)根据试管②中观察到的现象,可知乙酸乙酯的物理性质有
.



 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
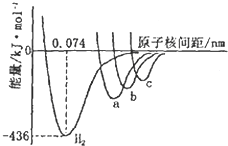 X元素在第3周期中电负性最大,Y、Z元素同主族且位置相邻,Y原子的最外层电子排布为nsnnpn+2.请填写下列空白.
X元素在第3周期中电负性最大,Y、Z元素同主族且位置相邻,Y原子的最外层电子排布为nsnnpn+2.请填写下列空白.
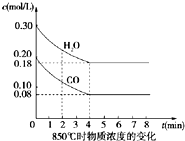 在一体积为10L密闭的容器中,通入一定量的CO和H2O(g),在850℃时发生以下反应:
在一体积为10L密闭的容器中,通入一定量的CO和H2O(g),在850℃时发生以下反应: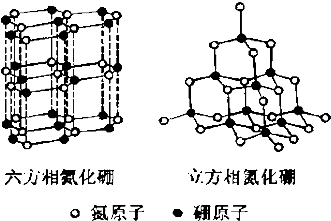 氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂.立方相氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图所示.
氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂.立方相氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图所示.