
| A.在试管里先注入少量NaOH溶液,振荡,然后加热煮沸。把NaOH溶液倒去后,再用蒸馏水洗净试管备用。 | B.在洗净的试管里配制银氨溶液。 | C.沿试管壁加入乙醛稀溶液。 |
| D.加热。请回答下列问题: |
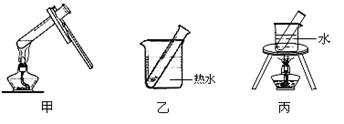
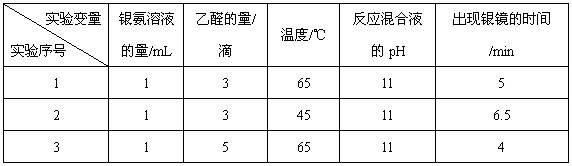

 在溶液中存在平衡:[Ag(NH3)2]
在溶液中存在平衡:[Ag(NH3)2]
 Ag
Ag +2NH3。
+2NH3。 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:实验题
 ;
;
 先通入水中?填“是”或”否”
先通入水中?填“是”或”否”  。
。
 。
。
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将SO2通入BaCl2溶液中产生白色沉淀,再滴加稀硝酸沉淀不消失 |
| B.用标准氢氧化钠溶液滴定一定量含甲基橙的盐酸,终点时溶液由橙色变成黄色 |
| C.取少量加碘食盐加入淀粉溶液中,充分搅拌后溶液呈蓝色 |
| D.配制FeSO4溶液时,加入少量稀硝酸以抑制其水解 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.加入硫代硫酸钠溶液后即开始记时,瓶中出现浑浊现象时记时结束 |
| B.加入硫代硫酸钠溶液后即开始记时,加入硫酸溶液后记时结束 |
| C.加入硫酸溶液后即开始记时,瓶中出现浑浊现象记时结束 |
| D.加入硫酸溶液后即开始记时,至看不到瓶底“十”字记时结束 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

A.图①表示可逆反应“CO(g) + H2O(g) CO2(g)+H2(g)”中的ΔH大于0 CO2(g)+H2(g)”中的ΔH大于0 |
| B.图②为电解硫酸铜溶液的装置,一定时间内,两电极产生单质的物质的量之比一定为1︰1 |
| C.图③实验装置可完成比较乙酸、碳酸、苯酚酸性强弱的实验 |
| D.图④量取0.10 mol?L-1KMnO420.00mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com