
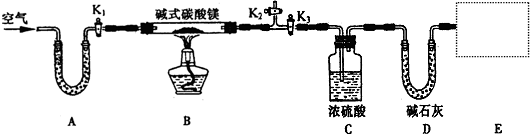
��12�֣�ij�о���ѧϰС��Ϊ�ⶨ��13.7gijNa2CO3��Ʒ�Ĵ��ȣ�����ֻ��NaHCO3���ʣ���ѡ����ͼ��ʾ������װ�ý���ʵ�飨��װ��δ��ȫ�����Իش��й����⣺
��1����ѡ���ʵ�������������װ�õ���ȷ˳����_ ��
��2������ʱNaHC03�ֽ�Ļ�ѧ����ʽΪ ��
��3����ɸ�ʵ����ȱ�IJ��������� �������ƣ������������װ�âܵ� ���룬��װ�âݵ� ���루��ӿ���ţ���
ʵ������ⶨ����ʵ����ɺ�ʣ����������ᷴӦ����CO2�������
��4�����Ⱥ�Ĺ������������ᷴӦ�����ӷ���ʽΪ ��
���ݷ��������ۣ�
��5���������������������ʱ������CO2����ڱ�״��ʱΪ2��24L����Na2CO3��Ʒ�Ĵ���Ϊ ��
��������
��6����ͬѧ��Ϊʵ��һ������ˮ��ʹ�����������������Ϊԭ������� ��
��7����ͬѧ������ʵ�顪��ȡCO2���ʱ������Һ���Һ����ڢ���Һ���Һ�棬��δ���κδ�������aֵ ���ƫ����ƫС������Ӱ�족����
 ѧ���������ν��Ͼ���ѧ������ϵ�д�
ѧ���������ν��Ͼ���ѧ������ϵ�д� Happy holiday���ּ��������ҵ�㶫���������ϵ�д�
Happy holiday���ּ��������ҵ�㶫���������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
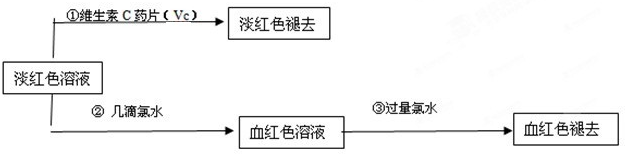
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
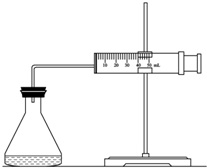 ʵ������H2O2�ֽⷴӦ��ȡ����ʱ������������Լӿ췴Ӧ���ʣ�ij�о���ѧϰС��Ϊ�о�����FeCl3������O2�������ʵ�Ӱ�죬�������������ʵ�鷽�������±������������������Լ���һ�������Ϻ���з�Ӧ��
ʵ������H2O2�ֽⷴӦ��ȡ����ʱ������������Լӿ췴Ӧ���ʣ�ij�о���ѧϰС��Ϊ�о�����FeCl3������O2�������ʵ�Ӱ�죬�������������ʵ�鷽�������±������������������Լ���һ�������Ϻ���з�Ӧ��| ʵ���� �Լ� |
A | B | C |
| 10% H2O2/mL | 20.0 | V1 | V2 |
| 2mol/L FeCl3/mL | 0 | 5.0 | 10.0 |
| H2O/mL | V3 | V4 | 0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
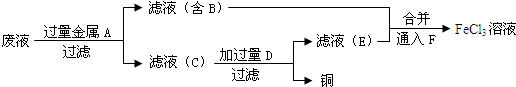
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ�긣��ʡ5�¸߿�����ģ�⻯ѧ�Ծ��������棩 ���ͣ������
��1��M�����ֶ�����Ԫ����ɣ�ÿ��M���Ӻ���18�����ӣ���������ģ����ͼ��ʾ�����M��Ħ������Ϊ32g/mol���������Ϊ2��ԭ�ӽṹʾ��ͼ�� ��
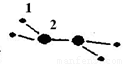
��2����֪1.0mol��L��1NaHSO3��Һ��pHΪ3.5��������ˮ������ҺpHѸ�ٽ��͡���ҺpH���͵�ԭ���� �������ӷ���ʽ��ʾ����
��3���ڳ��³�ѹ���������£�N2�ڴ�����TiO2��������H2O��Ӧ������1molNH3��O2ʱ�������仯ֵΪ382.5kJ���ﵽƽ���˷�ӦNH3���������¶ȵ�ʵ���������±�����÷�Ӧ���Ȼ�ѧ����ʽΪ ��
|
T/K |
303 |
313 |
323 |
|
NH3������/��10��1mol�� |
4.3 |
5.9 |
6.0 |
��4������Һ�У�һ��Ũ�ȵ�NH4�����ܽⲿ��Mg(OH)2���壬��Ӧ���£�
2NH4+(aq) + Mg(OH)2(s)
 Mg2+(aq)
+2NH3��H2O(aq)
Mg2+(aq)
+2NH3��H2O(aq)
д��������Ӧ��ƽ�ⳣ������ʽ
ij�о���ѧϰС��Ϊ̽��Mg2+��NH3��H2O��Ӧ�γɳ���������������������ʵ��
|
ʵ��� |
�����1 mol/L��ˮ��0.1 mol/L MgCl2��Һ��� |
���ɰ�ɫ���� |
|
ʵ��� |
�����0.1 mol/L��ˮ��1 mol/L MgCl2��Һ��� |
������ |
�����ʵ��١��ڲ�����ͬ�����ԭ�� ��
��5���������£���ѧ��ӦI��(aq)+ ClO��(aq) = IO��(aq) + Cl��(aq)�ķ�Ӧ���ʼŨ�ȡ���Һ�е����������ӳ�ʼŨ�ȼ���ʼ���ʼ�Ĺ�ϵ���±���ʾ��
|
ʵ���� |
I���ij�ʼŨ�� (mol��L��1) |
ClO���ij�ʼŨ�� (mol��L��1) |
OH���ij�ʼŨ�� (mol��L��1) |
��ʼ����v (mol��L��1�� s��1) |
|
1 |
2 �� 10��3 |
1.5 �� 10��3 |
1.00 |
1.8 �� 10��4 |
|
2 |
a |
1.5 �� 10��3 |
1.00 |
3.6 �� 10��4 |
|
3 |
2 �� 10��3 |
3 �� 10��3 |
2.00 |
1.8 �� 10��4 |
|
4 |
4 �� 10��3 |
3 �� 10��3 |
1.00 |
7.2 �� 10��4 |
��֪���г�ʼ��Ӧ�������й�����Ũ�ȹ�ϵ���Ա�ʾΪv= k [I��]1 [ClO��]b [OH��]c���¶�һ��ʱ��kΪ��������
�����ʵ��2��ʵ��4��Ŀ���� ��
����ʵ����4������Ũ�Ȳ��䣬������Һ�����ֵ���ΪpH = 13����Ӧ�ij�ʼ����v= ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com