
【题目】NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,22.4 L庚烷的分子数约为NA
B.1 L0.1mol/L的Na2S溶液中S2-和HS-的总数为0.1NA
C.4.0 g![]() 与D2O的混合物中所含中子数为2NA
与D2O的混合物中所含中子数为2NA
D.50 mL12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是( )
A. 人们最早先根据味道来获得朴素的酸、碱概念:一切有酸味的物质都是酸,一切有涩味的物质都是碱。
B. 波义耳基于指示剂变色来分辨酸碱:酸一定能使石蕊变红,碱一定能使石蕊变蓝。
C. 地球上最大规模的化学反应是植物的光合作用,人类利用氮肥的最有效的反应是合成氨反应。
D. 酸碱质子理论:凡是能给出![]() 的物质就是酸,凡是能结合
的物质就是酸,凡是能结合![]() 的物质就是碱,适用水溶液,也适用非水溶液或无水条件。
的物质就是碱,适用水溶液,也适用非水溶液或无水条件。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.100mol/L NaOH 溶液分别滴定20.00mL 0.100mol/L的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是

A. Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线
B. V(NaOH)=10.00 mL 时 >1
>1
C. pH=7时,两种酸所用NaOH溶液的体积相等
D. V(NaOH)=20.00 mL 时,c(Cl-)<c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种利用电解锰阳极泥(主要成分MnO2、MnO)制备MnO2的工艺流程如下:

(1)“煅烧氧化”时,1mol MnO煅烧完全转化为Na2MnO4失去电子的物质的量为___________;MnO2煅烧反应的化学方程式为__________________。
(2)“浸取”时,为提高Na2MnO4的浸取率,可采取的措施有____________、____________(列举2点)
(3)“调pH”是将溶液pH 调至约为10,防止pH较低时Na2MnO4自身发生氧化还原反应,生成MnO2和___________;写出用pH试纸测定溶液pH的操作_______________。
(4)“还原”时有无机含氧酸盐生成,发生反应的化学方程式为_____________。
(5)测定产品中MnO2质量分数的步骤如下:
步骤1. 准确称取mg产品,加入c1mol·L-1Na2C2O4溶液V1mL (过量)及适量的稀硫酸,水浴加热煮沸一段时间。(已知:Na2C2O4+2H2SO4+MnO2=MnSO4+2CO2↑+2H2O+Na2SO4)
步骤2. 然后用c2mol·L-1KMnO4标准溶液滴定剩余的Na2C2O4滴定至终点时消耗KMnO4标准溶液V2mL。(已知:5H2C2O4+2KMnO4+3H2SO4=2MnSO4+10CO2↑+K2SO4+8H2O)
步骤2达滴定终点时判断依据是_____________;产品中MnO2的质量分数为ω(MnO2)=____________(列出计算的表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液的酸碱性可用酸度![]() 表示,AG=lg
表示,AG=lg 。室温下,将
。室温下,将![]() 盐酸逐滴滴人
盐酸逐滴滴人![]()
![]()
![]() 氨水中,溶液的AG变化如图所示。下列说法正确的是( )
氨水中,溶液的AG变化如图所示。下列说法正确的是( )
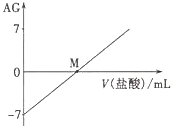
A.室温下,![]()
![]() 盐酸的
盐酸的![]()
B.M点时溶液中:![]()
C.M点加入盐酸的体积大于![]() mL
mL
D.M点以后NH4+的水解程度逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关离子共存的说法中正确的是( )
A.某无色溶液中可能大量存在![]() 、
、![]() 、
、![]() 、
、![]()
B.在水电离出![]() 浓度为
浓度为![]()
![]() 的澄淸透明溶液中可能大量存在
的澄淸透明溶液中可能大量存在![]() 、
、![]() 、
、![]() 、
、![]()
C.小苏打溶液中,可能大量存在![]() 、
、![]() 、
、![]() 、
、![]()
D.使甲基橙呈红色的溶液中,可能大量存在![]() 、
、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳和氮的化合物在生产、生活中广泛存在。请回答下列问题:
(1)资料显示,可用次氯酸钠处理废水中的氨氮![]() ,使其转化为氮气除去。其主要反应如下
,使其转化为氮气除去。其主要反应如下
I.![]()
![]()
![]()
![]()
①以上反应中HClO的来源用化学用语解释是______。
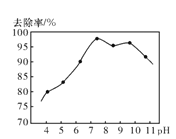
②实验测得。废水中pH与氨氮去除率的关系如图所示。pH较高时,氨氮去除率下降的原因是___。
(2)甲酶是重要的化工原料,又可作为燃料,工业上可利用CO或![]() 来生产燃料甲醇。已知制备甲醇的有关反应的化学方程式及其在不同温度下的化学平衡常数如下表所示。
来生产燃料甲醇。已知制备甲醇的有关反应的化学方程式及其在不同温度下的化学平衡常数如下表所示。
化学反应 | 平衡常数 | 温度/℃ | ||
500 | 700 | 800 | ||
|
|
|
|
|
|
|
|
|
|
|
| |||
①下列措施能使反应![]() 的平衡体系中
的平衡体系中![]() 增大的是______
增大的是______![]() 填字母代号
填字母代号![]() 。
。
A.将![]() 从体系中分离出去
从体系中分离出去![]() 充入
充入![]() ,使体系压强增大
,使体系压强增大
C.升高温度![]() 恒容时再充入1mol
恒容时再充入1mol![]()
![]()
②500℃时测得反应![]() 在某时刻
在某时刻![]() 、
、![]() 、
、![]() 、
、![]() 的浓度分別为
的浓度分別为![]() 、
、![]() 、
、![]() 、
、![]() ,则此时正
,则此时正![]() ______
______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() v
v![]() 逆
逆![]() 。
。
(3)常温下,在![]() 溶液中,反应
溶液中,反应![]() 的化学平衡常数
的化学平衡常数![]() ______。
______。![]() 已知:常温下,
已知:常温下,![]() 的电离平衡常数
的电离平衡常数![]() ,
,![]() 的电离衡常数
的电离衡常数![]() 、
、![]()
(4)电解硝酸上业的尾气NO可制备![]() ,其工作原理如图所示:
,其工作原理如图所示:
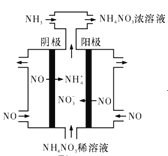
①阴极的电极反应式为______。
②将电解生成的![]() 全部转化为
全部转化为![]() ,则通入的
,则通入的![]() 与实际参加反应的NO的物质的量之比至少为___。
与实际参加反应的NO的物质的量之比至少为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 铅蓄电池在放电过程中,负极质量减小,正极质量增加
B. SO3与Ba(NO3)2溶液可得到BaSO4,SO2与Ba(NO3)2溶液可得到BaSO3
C. 明矾水解生成Al(OH)胶体,可用作净水剂
D. 室温下,SiO2(s)+3C(s)=SiC(s)+2CO(g)不能自发进行,则该反应的ΔH<0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com