
| A. | 酸性:HClO4>H2SO4 | |
| B. | Na、Mg与水反应,Na更剧烈 | |
| C. | 气态氢化物的稳定性:HF>HCl | |
| D. | 向Na2SO3溶液中加盐酸,有气泡产生 |
分析 A.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
B.元素的金属性越强,对应的单质与水反应越剧烈;
C.元素的非金属性越强,对应的氢化物越稳定;
D.向Na2SO3溶液中加盐酸,有气泡产生,只能说明盐酸的酸性比亚硫酸强.
解答 解:A.非金属性Cl>S,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,故A正确;
B.金属性Na>Mg,元素的金属性越强,对应的单质与水反应越剧烈,故B正确;
C.非金属F>Cl,元素的非金属性越强,对应的氢化物越稳定,故C正确;
D.向Na2SO3溶液中加盐酸,有气泡产生,只能说明盐酸的酸性比亚硫酸强,不能用元素周期率解释,故D错误.
故选D.
点评 本题考查原子结构与元素周期率,为高频考点,侧重考查学生的分析能力,注意把握元素周期律的递变规律以及物质的性质的比较角度,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
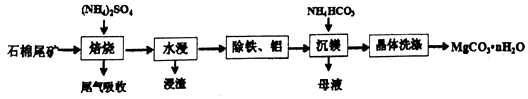
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离子组 | X试剂 | 离子方程式 |
| A | K+、Na+、ClO-、SO42- | 少量SO2 | SO2+ClO-+H2O═SO42-+Cl-+2H+ |
| B | NH4+、Fe3+、Br-、SO42- | 过量H2S | 2Fe3++H2S═2Fe2++S↓+2H+ |
| C | NH4+、Na+、Fe3+、[Al(OH)4]- | 过量铜粉 | 2Fe3++Cu═2Fe2++Cu2+ |
| D | K+、Na+、HCO3-、Al3+ | 少量HCl | H++HCO3-═CO2↑+H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.8gNH4+中含有的电子数为NA | |
| B. | 标准状况下,足量Na2O2与22.4LCO2气体充分反应,转移电子数为2NA | |
| C. | 2molSO2和1molO2在一定条件下充分反应,所得混合气体的分子数等于2NA | |
| D. | 298K时,1.0LpH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 44g乙醛中所含的氧原子数为NA | |
| B. | 足量的铜与40mL 10mol/L硝酸反应,生成气体的分子数为0.2NA | |
| C. | 14g乙烯中所含的C-H 键数目为2NA | |
| D. | 0.1 mol NH3中所含的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 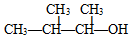 的命名为:3-甲基-2-丁醇 的命名为:3-甲基-2-丁醇 | |
| B. | 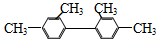 分子中至少有11个碳原子处于同一平面 分子中至少有11个碳原子处于同一平面 | |
| C. | 羟基的电子式是 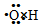 | |
| D. | 软脂酸和油酸互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
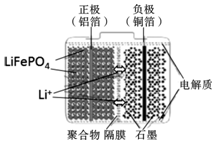 磷酸铁锂电池装置如图所示,其中正极材料橄榄石型LiFePO4通过粘合剂附着在铝箔表面,负极石墨材料附着在铜箔表面,电解质为溶解在有机溶剂中的锂盐.电池工作时的总反应为:LiFePO4+6C$?_{放电}^{充电}$ Li1-xFePO4+LixC6,则下列说法正确的是( )
磷酸铁锂电池装置如图所示,其中正极材料橄榄石型LiFePO4通过粘合剂附着在铝箔表面,负极石墨材料附着在铜箔表面,电解质为溶解在有机溶剂中的锂盐.电池工作时的总反应为:LiFePO4+6C$?_{放电}^{充电}$ Li1-xFePO4+LixC6,则下列说法正确的是( )| A. | 图中聚合物隔膜是阴离子交换膜 | |
| B. | 充电时,Li+迁移方向是“由右向左” | |
| C. | 放电时,正极的电极反应式为LiFePO4-xe-=Li1-xFePO4+xLi+ | |
| D. | 用该电池电解精炼铜,当转移电子1.25mol时能得到精铜32g,则电子利用率为80% |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验步骤 | 实验现象 |
| ①取少量固体于试管中,加入足量蒸馏水 | 得到无色溶液和白色不溶物 |
| ②向上述试管中加入足量稀盐酸 | 有气泡冒出,白色不溶物部分溶解 |
| ③将步骤②所得物过滤,取部分滤液于试管中,向其中加入少量硝酸银溶液 | 有白色沉淀生成 |
| ④另取步骤③所得滤液少许于试管中,向其中加入足量氢氧化钠溶液 | 无明显现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 一 | ① | |||||||
| 二 | ② | ③ | ④ | ⑤ | ⑥ | |||
| 三 | ⑦ | ⑧ | ⑨ | ⑩ | ||||
| 四 | ⑪ | ⑫ | ⑬ | |||||

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com