
物质的量浓度相同的下列溶液中,符合按pH由小到大的顺序排列的是( )
A.Na2CO3 NaHCO3 NaCl NH4Cl
B.Na2CO3 NaHCO3 NH4Cl NaCl
C.(NH4)2SO4 NH4Cl NaNO3 Na2S
D.NH4Cl (NH4)2SO4 Na2S NaNO3
科目:高中化学 来源: 题型:
全球气候变暖已经成为全世界人类面临的重大问题。
(1)地球上的能主要于太阳,绿色植物的光合作用可以大量吸收CO2以减缓温室效应,主要过程可以描述分为下列三步(用“C5”表示C5H10O4,用“C3”表示C3H6O3):
Ⅰ:H2O(l)=2H+(aq)+1/2O2(g)+2e- △H=+284kJ/mol
Ⅱ:CO2(g)+C5(s)+2H+(aq)=2C3+(s) △H=+396kJ/mol
Ⅲ:12C3+(s)+12e-=C6H12O6(葡萄糖、s)+6C5(s)+3O2(g)△H=-1200kJ/mol
写出绿色植物利用水和二氧化碳合成葡萄糖并放出氧气的热化学方程式
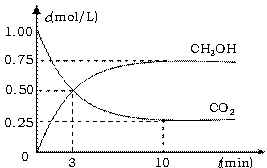
(2)工业上有一种方法有效地开发利用CO2,是用CO2生产燃料甲醇。为探究反应原理,进行如下实验,在体积为1 L的恒容密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)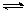 CH3OH(g)+H2O(g)△H=-49.0kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如下图左所示。
CH3OH(g)+H2O(g)△H=-49.0kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如下图左所示。
①从反应开始到平衡,氢气的平均反应速率v(H2)= mol/(L·min);
②氢气的转化率= ;
③求此温度下该反应的平衡常数K= ;
④下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是 。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出去 D.再充入1mol CO2和3mol H2
⑤当反应达到平衡时,H2的物质的量浓度为c1,然后向容器中再加入一定量H2,待反应再一次达到平衡后,H2的物质的量浓度为c2。则c1 c2的关系(填>、<、=)。
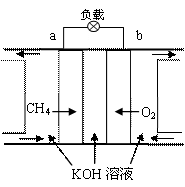
(3)减少温室气体排放的关键是节能减排,大力开发利用燃料电池就可以实现这一目标。如上图右所示甲烷燃料电池就是将电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。将其插入KOH溶液,从而达到吸收CO2的目的。
① 通入氧气一极的电极反应式为 ;
② 随着电池不断放电,电解质溶液的pH
(填“增大”、“减小”或“不变”)。
③通常情况下,甲烷燃料电池的能量利用率
(填大于、小于或等于)甲烷燃烧的能量利用率。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学知识在生产、生活中有着广泛的应用.下列说法中不正确的是( )
A. 用植物秸秆、动物粪便等生产的沼气是一种清洁的能源
B. 手机上用的锂离子电池属于二次电池
C. 海水淡化能解决淡水供应危机,向海水中加净水剂明矾可以使海水淡化
D. 研制开发燃料电池汽车,可有效降低机动车尾气污染
查看答案和解析>>
科目:高中化学 来源: 题型:
镁是一种重要的金属资源,工业上制取镁单质主要是电解法.
(1)电解法制取镁单质的反应方程式是: .
(2)电解原料无水氯化镁可由海水制备.主要有以下步骤:①在一定条件下脱水干燥;②加熟石灰;③加盐酸;④过滤;⑤浓缩冷却结晶.
其步骤先后顺序是 ;(每步骤可重复使用)
(3)上述步骤①中“一定条件下”具体是指: ,其目的是 .
(4)已知某温度下Mg(OH)2的Ksp=6.4×l0﹣12,当溶液中c(Mg2+)≤1.0×10﹣5mol•L﹣1可视为沉淀完全,则此温度下应保持溶液中c(OH﹣)≥ mol•L﹣1.
(5)饱和NH4Cl溶液滴入少量的Mg(OH)2悬浊液中,看到的现象是 .反应原理可能有两方面,请分别用离子方程式表示:① ;② .
要验证①②谁是Mg(OH)2溶解的主要原因,可选取 代替NH4Cl溶液作对照实验.
A.NH4NO3 B.(NH4)2SO4 C.CH3COONH4 D.NH4HCO3
(6)镁电池是近年来科学技术研究的热点之一.一种“镁﹣次氯酸盐”电池的总反应为:
Mg+ClO﹣+H2O═Mg(OH)2+Cl﹣.其工作时正极的电极反应式: ClO﹣+2e﹣+H2O=Cl﹣+2OH﹣ ;用此镁电池给铅蓄电池充电,下列说法中正确的是 .
A.镁电池正极与铅蓄电池正极相连
B.电子从Pb电极转移到镁电池负极
C.充电后,铅蓄电池两极质量均减小,理论上镁电池消耗24g Mg,阴、阳极的质量变化之比为3:2
D.充电后,镁电池和铅蓄电池的pH均增大.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,[SO ]>[NH
]>[NH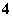 ]
]
B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D.向0.1 mol·L-1的氨水中加入少量硫酸铵固体,则溶液中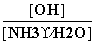 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,将0.01 mol CH3COONa和0.002 mol HCl溶于水,形成1 L溶液。
(1)该溶液中共含有______种不同的微粒(包括分子和离子)。
(2)在这些微粒中,________和________两种微粒的物质的量之和等于0.01 mol。
(3)________和________两种微粒的物质的量之和比H+的物质的量多0.008 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
将28 g铁粉放入100 mL 0.1 mol/L的CuSO4溶液中,充分反应后析出的铜的质量为( )
A.32 g B.6.4 g
C.0.64 g D.3.2 g
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上合成氨时一般采用700 K左右的温度,其原因是( )
①提高合成氨的速率 ②提高氢气的转化率 ③提高氨的产率 ④催化剂在700 K时活性最大
A.只有① B.①②
C.②③④ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
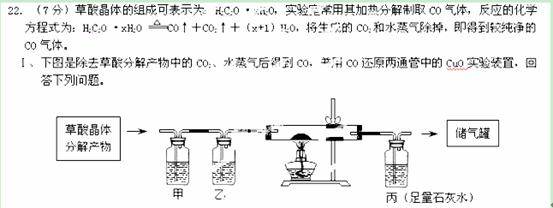
(1)在甲洗气瓶中所盛溶液是 ▲ 。
(2)CuO全部被还原后停止实验操作的步骤的有:①停止通气体,②熄灭酒精灯,③拆下实验装置, ④继续通气体到两通管冷却止。其正确的操作顺序是 ▲ 。
A.④②①③ B.①②③ C.②④①③ D.②④③
Ⅱ、为测定草酸晶体的x值,进行下列实验:
①取wg草酸晶体配成100mL水溶液;
②量取25.00mL草酸溶液置于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol·L-1KMnO4溶液滴定。滴定时,所发生的反应为:
2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
请回答下列问题:
(1)实验②中,滴定时,KMnO4溶液应装在 ▲ (填“酸式滴定管”、“碱式滴定管”)中。
(2)判断滴定终点的方法是 ▲ 。若滴定时,前后两次读数分别为a mL和b mL,由此计算出该草酸晶体的x值是 ▲ 。
(3)下列操作会引起测得的x值偏大的是 ▲ (填选项)
A.滴定结束时俯视读数
B.滴定结束后滴定管尖嘴处还有一滴标准液悬而未滴
C.锥形瓶未干燥即装入草酸溶液
D.滴定管用蒸馏水洗净后即装入KMnO4溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com