
| A. |  装置所示装置可实现反应:Cu+2H2O$\frac{\underline{\;通电\;}}{\;}$Cu(OH)2+H2↑ | |
| B. | 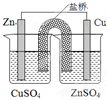 装置能构成锌铜原电池 | |
| C. |  装置可用于粗铜的电解精炼 | |
| D. |  装置可用于在实验室测定中和反应的反应热 |
分析 A.Cu作阳极失电子生成铜离子,阴极上氢离子得电子生成氢气;
B.左边烧杯中发生置换反应,无法产生电流;
C.电解精炼时粗铜作阳极;
D.通过测定反应前后温度的变化来测定中和热.
解答 解:A.Cu作阳极失电子生成铜离子,阴极上氢离子得电子生成氢气,所以用铜电极电解硫酸钠溶液的离子方程式为:Cu+2H2O$\frac{\underline{\;通电\;}}{\;}$Cu(OH)2+H2↑,故A正确;
B.含有盐桥的原电池中,金属电极材料和电解质溶液中金属元素属于同一种元素,所以应该将铜插入硫酸铜溶液中、锌插入硫酸锌溶液中才能构成原电池,故B错误;
C.电解精炼时粗铜作阳极,精铜作阴极,阳极上铜失电子生成铜离子,阴极上铜离子得电子生成Cu,故C错误;
D.通过测定反应前后温度的变化来测定中和热,该装置可用于在实验室测定中和反应的反应热,故D正确.
故选AD.
点评 本题考查实验方案评价,涉及原电池原理、中和热测定、电解原理等知识点,侧重实验操作和实验原理的考查,注意实验方案的操作性、可行性、评价性分析,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 杂质在溶剂中的溶解度常温时很小,加热时很大 | |
| B. | 在室温时,产品在溶剂中易溶 | |
| C. | 产品在溶剂中的溶解度随温度升高而迅速增大 | |
| D. | 在同一溶剂中,产品比杂质易溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发生氧化反应的为负极 | B. | 正极为电子流入的一极 | ||
| C. | 比较不活泼的金属为负极 | D. | 电流的方向由正极到负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
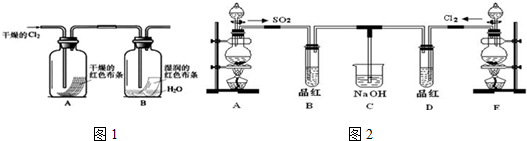
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
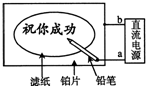 某学生设计了一个“黑笔写红字”的趣味实验.滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,下列叙述正确的是( )
某学生设计了一个“黑笔写红字”的趣味实验.滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,下列叙述正确的是( )| A. | 铅笔端作阳极,发生氧化反应 | B. | 铂片端作阴极,发生还原反应 | ||
| C. | 铅笔端有少量的氯气产生 | D. | a点是负极,b点是正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 | |
| B. | 用装置①进行电镀,镀件接在b极上 | |
| C. | 装置②的总反应是:Cu+Fe3+═Cu2++Fe | |
| D. | 装置③中的铁钉几乎没被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时每转移3mol电子,正极有1mol K2FeO4被氧化 | |
| B. | 充电时阳极反应为:Fe(OH)3-3e-+5 OH-═FeO${\;}_{4}^{2-}$+4H2O | |
| C. | 放电时正极附近溶液的碱性增强 | |
| D. | 放电时负极反应为:Zn-2e-+2OH-═Zn(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com