
【题目】已知NO2与以SO2能发生反应:NO2(g)+SO2(g)![]() SO3(g)+NO(g)。
SO3(g)+NO(g)。
(1)上述反应涉及的四种氧化物中,_________(填化学式)属于酸性氧化物。
(2)已知:2NO(g)+O2(g)=2NO2(g)△H1=-113.0kJ·mol-1
2SO2(g)+O2(g) ![]() 2SO3(g)△H2=-196.6kJ·mol-1
2SO3(g)△H2=-196.6kJ·mol-1
则NO2(g)+SO2(g)![]() SO3(g)+NO(g)△H=__________
SO3(g)+NO(g)△H=__________
(3)在一恒容密闭容器中,改变原料气配比[n0(NO2):n0(SO2)]进行多组实验(每次实验的温度可能相同,也可能不同),测定NO2的平衡转化率[a(NO2)]。部分实验结果如图所示。

① 当容器内____(填字母)不再随时间的变化而改变时,可以判断反应达到了化学平衡状态。
a.气体的压强 b.气体的平均摩尔质量 c.气体的密度 d. NO2的体积分数
② 若A点对应的实验中,SO2(g)的起始浓度为c0mol/L,经过t min后反应达到平衡,则反应从起始至t min 内的化学反应速率v(NO2)=_____mol/(L·min)。
③ 若要使图中C点的平衡状态变为B 点的平衡状态,则应采取的措施是_________,若要使图中A点的平衡状态变为B 点的平衡状态,则应采取的措施是___________。
(4)将NO2与SO2的混合气体[n0(NO2):n0(SO2)=1]通入2mL0.1mol/L氯化钡溶液中,只生成一种白色沉淀物M,M的化学式为_______,当溶液中的Ba2+恰好完全沉淀(Ba2+的浓度等于1.0×10-5mol/L),通入的混合气体在标准状况下的体积约为______L。(M的Kap=1.0×10-9)
【答案】 SO3、SO2 -41.8KJ/mol d c0/5t 将NO2和SO2的物质的量之比调节为1:1 将NO2和SO2物质的量之比调节为1:1的同时降低温度 BaSO4 8.96×10-3
【解析】(1)本题考查物质的分类,酸性氧化物是与水反应生成相应的酸,且化合价不变化,或与碱反应生成盐和水, NO2与水反应:3NO2+H2O=2HNO3+NO,存在化合价变化,因此NO2不属于酸性氧化物,NO是不成盐氧化物,因此属于酸性氧化物的是SO2、SO3;(2)考查热化学反应方程式的计算,①2NO(g)+O2(g)=2NO2(g),②2SO2(g)+O2(g) ![]() 2SO3(g),(②-①)/2得出:△H=(-196.6+113.0)/2kJ·mol-1=-41.8kJ·mol-1;(3)本题考查化学反应速率的计算、化学平衡状态的判断、影响化学平衡移动的因素,①a、因为前后气体系数之和相等,因此压强不变,不能说明反应达到平衡,故a错误;b、根据M=m/n,组分都是气体,因此气体质量不变,反应前后气体系数之和相等,因此气体物质的量不变,即M不变,不能说明反应达到平衡,故b错误;c、根据ρ=m/V,组分都是气体,气体的质量不变,容器是恒容状态V不变,因此密度不变,不能说明反应达到平衡,故c错误;d、根据化学平衡状态的定义,当组分的浓度或体积分数不变,说明反应达到平衡,故d正确;②A点对应的n(NO2)/n(SO2)=0.4,起始时c(SO2)=c0mol·L-1,因为容器的体积不变,因此起始时c(NO2)=0.4c0mol·L-1,A点对应的NO2的转化率为50%,因此消耗的NO2的浓度为0.4c0×50%mol·L-1,依据化学反应速率的数学表达式,v(NO2)=0.4c0×50%/tmol/(L·min)=0.2c0/t mol/(L·min)或c0/5tmol/(L·min);③C点对应n(NO2)/n(SO2)=1.5,B点对应n(NO2)/n(SO2)=1,C点转化成B点,在C点增加SO2,调节到n(NO2)/n(SO2)=1,NO2的转化率增加,即C点的平衡状态变为B点平衡状态;A点对应n(NO2)/n(SO2)=0.4,A点转化成B点,需要减少SO2,达到n(NO2)/n(SO2)=1,此时平衡向逆反应方向进行,NO2的转化率降低,但维持NO2的转化率不变,因为正反应是放热反应,因此需要同时降低温度;(4)考查溶度积的计算,NO2与水反应:3NO2+H2O=2HNO3+NO,SO2具有还原性,因此有2H2O+2HNO3+3SO2=3H2SO4+2NO,然后发生BaCl2+H2SO4=BaSO4↓+2HCl,因此沉淀M是BaSO4,根据溶度积,求出溶液中c(SO42-),即c(SO42-)=Ksp/c(Ba2+)=1.0×10-9/1×10-5mol·L-1=1×10-4mol·L-1,因此溶液中n(SO42-)=2×10-3×10-4mol·L-1=2×10-7mol·L-1,Ba2+全部转化成沉淀,则BaSO4的物质的量为2×10-3×0.1mol=2×10-4mol,根据硫元素守恒,即SO2的物质的量为(2×10-4+2×10-7)mol≈2×10-4mol,n(NO2)/n(SO2)=1,则n(NO2)= 2×10-4mol,气体总物质的量为4×10 -3mol,气体体积为8.96×10-3L。
2SO3(g),(②-①)/2得出:△H=(-196.6+113.0)/2kJ·mol-1=-41.8kJ·mol-1;(3)本题考查化学反应速率的计算、化学平衡状态的判断、影响化学平衡移动的因素,①a、因为前后气体系数之和相等,因此压强不变,不能说明反应达到平衡,故a错误;b、根据M=m/n,组分都是气体,因此气体质量不变,反应前后气体系数之和相等,因此气体物质的量不变,即M不变,不能说明反应达到平衡,故b错误;c、根据ρ=m/V,组分都是气体,气体的质量不变,容器是恒容状态V不变,因此密度不变,不能说明反应达到平衡,故c错误;d、根据化学平衡状态的定义,当组分的浓度或体积分数不变,说明反应达到平衡,故d正确;②A点对应的n(NO2)/n(SO2)=0.4,起始时c(SO2)=c0mol·L-1,因为容器的体积不变,因此起始时c(NO2)=0.4c0mol·L-1,A点对应的NO2的转化率为50%,因此消耗的NO2的浓度为0.4c0×50%mol·L-1,依据化学反应速率的数学表达式,v(NO2)=0.4c0×50%/tmol/(L·min)=0.2c0/t mol/(L·min)或c0/5tmol/(L·min);③C点对应n(NO2)/n(SO2)=1.5,B点对应n(NO2)/n(SO2)=1,C点转化成B点,在C点增加SO2,调节到n(NO2)/n(SO2)=1,NO2的转化率增加,即C点的平衡状态变为B点平衡状态;A点对应n(NO2)/n(SO2)=0.4,A点转化成B点,需要减少SO2,达到n(NO2)/n(SO2)=1,此时平衡向逆反应方向进行,NO2的转化率降低,但维持NO2的转化率不变,因为正反应是放热反应,因此需要同时降低温度;(4)考查溶度积的计算,NO2与水反应:3NO2+H2O=2HNO3+NO,SO2具有还原性,因此有2H2O+2HNO3+3SO2=3H2SO4+2NO,然后发生BaCl2+H2SO4=BaSO4↓+2HCl,因此沉淀M是BaSO4,根据溶度积,求出溶液中c(SO42-),即c(SO42-)=Ksp/c(Ba2+)=1.0×10-9/1×10-5mol·L-1=1×10-4mol·L-1,因此溶液中n(SO42-)=2×10-3×10-4mol·L-1=2×10-7mol·L-1,Ba2+全部转化成沉淀,则BaSO4的物质的量为2×10-3×0.1mol=2×10-4mol,根据硫元素守恒,即SO2的物质的量为(2×10-4+2×10-7)mol≈2×10-4mol,n(NO2)/n(SO2)=1,则n(NO2)= 2×10-4mol,气体总物质的量为4×10 -3mol,气体体积为8.96×10-3L。


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是
A.氢氧化钠与盐酸;氢氧化钠与碳酸
B.BaCl2溶液与Na2SO4溶液;Ba(OH)2溶液与H2SO4溶液
C.Na2CO3溶液与硝酸溶液;NaHCO3溶液与硝酸溶液
D.石灰石与硝酸;石灰石与盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛被誉为“21世纪金属”。工业上用钛矿石(FeTiO3,含少量FeO、A12O3、SiO2等杂质)制得海绵钛的流程如下。
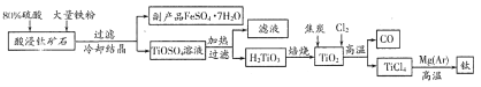
回答下列问题:
(1)要提高酸浸时钛矿石的溶解速率,请提供可行的措施_________________,酸浸时主要反应的化学方程式为________________________________。
(2)副产品中含有杂质[Al2(SO4)3]。要将副产品进一步提纯,请结合下图的绿矾溶解度曲线完成提纯过程:
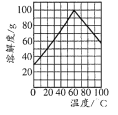
将副产品溶于稀硫酸中,加入足量的铁粉,充分搅拌后,用NaOH溶液调节反应液的pH约为5,过滤沉淀后得到FeSO4溶液,______,过滤,用冰水洗涤,低温干燥,得到FeSO4·7H20晶体。
(3)高温时,由TiO2转化为TiC14的化学方程式为________________。在一定条件下,将足量TiO2(s)和固体炭放入密闭容器中,再通入C12进行反应至平衡,当改变外界条件时,TiC14(g)体积分数φ(TiCl4)变化的趋势如右图所示,由图判断:①该反应的△H____0(填“>”或“<”)。

②在750℃、100MPa和800℃、200MPa下C12的转化率分别为α1、α2,则α1______α2 (填“>”“<”或“=”)。
(4)常温下,H2TiO3的沉淀溶解平衡为H2TiO3(s)![]() TiO2+(aq)+2OH-(aq),其溶度积常数Ksp=1.0×10-29mol3·L-3。若在TiOSO4溶液中加入NaOH溶液调pH使TiO2+完全沉淀(当离子浓度等于或小于10-5mol·L-1时可认为完全沉淀),则此时溶液的pH至少为_________________。
TiO2+(aq)+2OH-(aq),其溶度积常数Ksp=1.0×10-29mol3·L-3。若在TiOSO4溶液中加入NaOH溶液调pH使TiO2+完全沉淀(当离子浓度等于或小于10-5mol·L-1时可认为完全沉淀),则此时溶液的pH至少为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由U形管、铁棒、石墨棒、1 L 0.lmol/L CuCl2溶液等组成如图装置,下列说法不正确的是

A. 同时打开K1、K2,铁棒上有紫红色物质析出
B. 只闭合K1,石墨棒上有紫红色物质析出
C. 只闭合K2,当电路中通过0.3mol电子时,两极共产生4.48L(标准状况)气体
D. 只闭合K2,一段时间后,将电解质溶液搅拌均匀,溶液的pH变大(不考虑Cl2的溶解)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大,其中Z的原子序数为W的2倍。n、p、q是由这些元素组成的二元化合物,常温下n为气体.m、r、s分别是Z、W、X的单质,t的水溶液显碱性且焰色反应呈黄色,上述物质间的转化关系如图所示。下列说法正确的是

A. 原子半径:Z>Y
B. 化合物p中只存在离子键
C. 最简单气态氢化物的稳定性:W>X
D. 图示转化关系涉及的反应均为氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 化学反应的实质是旧键的断裂,新键的生成
B. CH4、CF4、CCl4、CBr4熔沸点逐渐升高,原因是分子间作用力逐渐增大
C. NH3和H2O间可以形成氢键,这也是氨极易溶于水的原因之一
D. NH4H中含有离子键、极性键、非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C9H12的芳香化合物,苯环上只有一个支链,则其苯环上的一氯代物共有多少种(不含立体结构)
A. 3种 B. 4种 C. 5种 D. 6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分,下列关系正确的是( )

A. 还原性:Se2->S2->Cl- B. 热稳定性:HCl>H2Se>HBr
C. 原子半径:Se>Cl>S D. 酸性:HBrO4>HClO4>S2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】抗痫灵(G)具有抗癫痫、抗惊厥、抗抑郁等功效,其合成路线如下图所示(某些反应条件和副产物已略):

(1)A中含氧官能团名称是______;简述证明A含有该官能团的实验方法:_________。
(2)若以醛基为母体,则B的系统命名法的名称为_______;①~⑥的反应中属于加成反应的是____ (填序号)。
(3)芳香化合物H是C的同分异构体,H的相关信息如下:
a.可发生银镜反应; b.可与NaHCO3溶液反应生成气体;c.苯环上的一溴代物有2种,则H的结构简式为__________。
(4)写出反应⑥的化学反应方程式:_____________。
(5)( )的单体是薰衣草的调和香料,以苯甲醛(
)的单体是薰衣草的调和香料,以苯甲醛(![]() )为起始原料(其余有机、无机原料任选),参照G的合成,设计并补充完成下列合成路线图:__________(空格内有几步,写几步。)
)为起始原料(其余有机、无机原料任选),参照G的合成,设计并补充完成下列合成路线图:__________(空格内有几步,写几步。)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com