
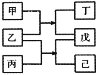
【题目】短周期元素W、X、Y、Z原子序数依次增大,甲、乙、丙、丁、戊、己是由这些元素构成的物质。常温下,丙和戊是单质气体,乙为生活中常见的无色液体,戊能使带火星的木条复燃,0.01mol/L丁溶液pH=12,上述物质的转化关系如图所示.下面说法正确的是
A.原子半径:X<Y<ZB.单质沸点:W>X
C.气态氢化物的热稳定性:X>YD.Y和Z形成的化合物溶于水显碱性
【答案】D
【解析】
短周期元素W、X、Y、Z原子序数依次增大,甲、乙、丙、丁、戊、己是由这些元素构成的物质。常温下,丙和戊是单质气体,乙为生活中常见的无色液体,乙为H2O,戊能使带火星的木条复燃,戊为O2,0.01mol/L丁溶液pH=12,丁是强碱,为NaOH,根据图中物质的转化关系得:乙+丙=戊+己,丙为F2,己为HF,又甲+乙=丁+戊得:甲为Na2O2,短周期元素W、X、Y、Z原子序数依次增大,整理得 W为H、X为O、Y为F、Z为Na,甲为Na2O2、乙为H2O、丙为F2、丁为NaOH、戊为O2、己为HF。
A. 同周期从左到右,原子半径逐渐减小,原子半径应为:Y<X<Z,故A错误;
B. 分子晶体,相对分子质量越大,单质沸点越高,氢气的相对分子质量为2,氧气分子质量为32,单质沸点:W<X,故B错误;
C. 同周期从左到右,气态氢化物稳定性增强,气态氢化物的热稳定性:X<Y,故C错误;
D. Y和Z形成的化合物NaF属于强碱弱酸盐,溶于水后水解,水溶液显碱性,故D正确;
故选D。


科目:高中化学 来源: 题型:
【题目】经测定乙醇的分子式是![]() ,由于有机化合物普遍存在同分异构现象,推测乙醇分子的结构可能是下列两种之一:
,由于有机化合物普遍存在同分异构现象,推测乙醇分子的结构可能是下列两种之一:
Ⅰ.  Ⅱ.
Ⅱ. 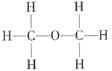
为确定其结构,应利用物质的特殊性质进行定性、定量实验。现给出乙醇、钠、水及必要的仪器,甲、乙、丙三名学生利用如图所示装置进行实验确定乙醇分子的结构。图中量气装置由甲、乙两根玻璃管组成,它们用橡皮管连通,并装入适量水。甲管有刻度(0~200mL),供量气用;乙管可上下移动,以调节液面高低。

(1)学生甲得到一组实验数据;
乙醇的物质的量 | 氢气的体积(标准状况下) |
0.01mol | 0.112L |
根据以上数据推断,乙醇的结构应为___________________(填“Ⅰ”或“Ⅱ”),原因是_______________
(2)学生乙认为:为了较准确地测量氢气的体积,除了必须检查整个装置的气密性外,在读取反应前后甲管中液面读数的过程中,应注意___________________(填序号)。
a.视线与凹液面最低处相平
b.等待片刻,待乙管中液面不再上升时,立刻读数
c.读数时应上下移动乙管,使甲、乙两管液面相平
d.读数时不一定使甲、乙两管液面相平
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对离子化合物的叙述正确的是( )
![]() 离子化合物一定是含有离子键的化合物
离子化合物一定是含有离子键的化合物
![]() 离子化合物一定是由金属元素和非金属元素组成
离子化合物一定是由金属元素和非金属元素组成
![]() 离子化合物熔点高,加热一定难分解
离子化合物熔点高,加热一定难分解
![]() 化合物在液态时导电的是离子化合物,不导电的是共价化物
化合物在液态时导电的是离子化合物,不导电的是共价化物
A. ①④B. ②③C. ①④②③D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年全国各地雾霾严重,为有效控制雾霾,各地积极采取措施改善大气质量。研究并有效控制空气中氮氧化物、碳氧化物等污染物是一项重要而艰巨的工作。氮氧化物的研究
![]() 一定条件下,将2molNO与
一定条件下,将2molNO与![]() 置于恒容密闭容器中发生反应:
置于恒容密闭容器中发生反应:![]() ,下列状态能说明该反应达到化学平衡的是______
,下列状态能说明该反应达到化学平衡的是______![]() 填字母编号
填字母编号![]() 。
。
A.混合气体的密度保持不变![]() 的转化率保持不变
的转化率保持不变
C.NO和![]() 的物质的量之比保持不变
的物质的量之比保持不变![]() 的消耗速率和
的消耗速率和![]() 的消耗速率相等
的消耗速率相等
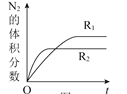
![]() 已知反应
已知反应![]() ,在不同条件时
,在不同条件时![]() 的体积分数随时间
的体积分数随时间![]() 的变化如图所示。根据图象可以判断曲线
的变化如图所示。根据图象可以判断曲线![]() 、
、![]() 对应的下列反应条件中不同的是______
对应的下列反应条件中不同的是______![]() 填字母序号
填字母序号![]() 。
。
A.压强![]() 温度
温度![]() 催化剂
催化剂
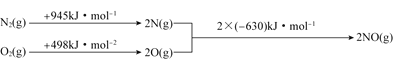
根据上图中的能量变化数据,计算反应![]() 的
的![]() ______。
______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁铝合金5.1 g溶于300 mL2 mol·L-1盐酸中,标准状况下放出气体的体积为5.6 L,向反应后的溶液中加入500 mLNaOH溶液充分反应,最终产生白色沉淀。下列有关说法不正确的是
A.5.1 g镁铝合金中含有镁、铝的质量分别为2.4 g、2.7 g
B.溶解5.1 g镁铝合金时,剩余盐酸中溶质的物质的量为0.1 mol
C.若白色沉淀只有Mg(OH)2,该NaOH溶液的物质的量浓度至少为1.2 mol·L-1
D.生成白色沉淀的最大质量为13.6 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠可作为氧气的来源。常温常压下二氧化碳和过氧化钠反应后,若固体质量增加了28 g,反应中有关物质的物理量正确的是(NA表示阿伏加德罗常数)
二氧化碳 | 碳酸钠 | 转移的电子 | |
A | 1mol | NA | |
B | 22.4L | 1mol | |
C | 106 g | 1mol | |
D | 106g | 2NA |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以苯为主要原料,制取高分子材料F和G的流程如下:

已知:
(1)由![]() 生成
生成![]() 的反应类型是____。
的反应类型是____。
(2)E中所含官能团的名称是_____。
(3)化合物C、G的结构简式分别是____、____。
(4)由B反应生成D的化学方程式是____。
(5)下列说法正确的是___(选填序号字母)。
a.常温下,A能和水以任意比混溶
b.B的核磁共振氢谱共有6组峰,面积比为1∶1∶1∶2∶2∶3
c.化合物A、B、C 、D中仅有一种物质含有手性碳
d.生成F和G的反应类型相同
(6)符合下列条件的B的同分异构体有____种。
a.能与饱和溴水反应生成白色沉淀
b.属于酯类
c.苯环上只有两个对位取代基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)是一种重要的清洁燃料气,其储运、燃烧安全性、理论燃烧温度等性能指标均优于液化石油气,也可用作燃烧电池,具有很好的发展前景。
(1)已知 H2、CO 和CH3OCH3的燃烧热(ΔH)分别为-285.5kJ/mol、 -283kJ/mol 和-1460.0kJ/mol,则工业上利用水煤气成分按 1:1 合成二甲醚的热化学方程式为: ____________。
(2)工业上采用电浮远凝聚法处理污水时,保持污水的pH在5.0,通过电解生成 Fe(OH)3胶体,吸附不溶性杂质,同时利用阴极产生的 H2,将悬浮物带到水面,利于除去。实验室以二甲醚燃料电池模拟该方法设计的装置如下图所示:
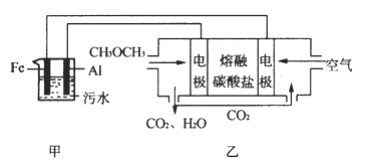
①乙装置以熔融碳酸盐为电解质,稀土金属材料为电极。写出该燃料电池的正极电极反应式 __________;下列物质可用做电池熔融碳酸盐的是 ______。
A.MgCO3 B.Na2CO3 C.NaHCO3 D.(NH4)2CO3
②写出甲装置中阳极产物离子生成Fe(OH)3沉淀的离子方程式____________________。
③已知常温下 Ksp[Fe(OH)3]=4.0×10-38,电解一段时间后,甲装置中 c(Fe3+)=___________。
④已知:H2S的电离平衡常数: K1=9.1×10-8、 K2=1.1×10-12; H2CO3的电离平衡常数:K1=4.31×10-7、 K2=5.61×10-11。测得电极上转移电子为 0.24mol 时,将乙装置中生成的 CO2通入200mL 0.2mol/L的Na2S溶液中,下列选项正确的是______
A.发生反应的离子方程式为:CO2+S2-+H2O=CO32-+H2S
B.发生反应的离子方程式为: CO2+S2-+H2O=HCO3-+HS-
C.c(Na+)=2[c(H2S)+c(HS-)+c(S2-)
D.c(Na+)+c(H+)=2c(CO32-)+2c(S2-)+c(OH-)
E. c(Na+)>c(HCO3-)>c(HS-)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年10月15日,中国用“长征三号乙”运载火箭成功以“一箭双星”方式发射北斗三号全球组网卫星系统第15、16号卫星,其火箭推进剂为高氯酸铵(NH4ClO4)等。制备NH4ClO4的工艺流程如下:
饱和食盐水![]() NaClO3
NaClO3![]() NaClO4
NaClO4![]() NaClO4
NaClO4![]()
![]() NH4ClO4,下列说法错误的是( )
NH4ClO4,下列说法错误的是( )
A.NH4ClO4属于离子化合物
B.溶解度:NaClO4>NH4ClO4
C.该流程中可循环利用的物质是NH4Cl
D.高氯酸铵中氯元素的化合价为+7价
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com