
【题目】A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中B与C同周期,D与E和F同周期,A与D同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的主族元素。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题:
(1)元素D在周期表中的位置__________。
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示)______。
(3)由A、B、C三种元素以原子个数比4∶2∶3形成化合物X,X中所含化学键类型有________________________________________________________________________。
(4)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出反应的化学方程式:________________________________________________________________________。
若E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式:_______________________________________________________________。
(5)FC2气体有毒,排放到大气中易形成酸雨,写出FC2与氧气和水蒸气反应的化学方程式______________________________________________________________________。
【答案】第三周期第IA族 S2-> O2-> Na+ 离子键、共价键 2Al+Fe2O3![]() Al2O3+2Fe SiO2+2OH-=SiO32-+H2O 2SO2+O2+2H2O=2H2SO4
Al2O3+2Fe SiO2+2OH-=SiO32-+H2O 2SO2+O2+2H2O=2H2SO4
【解析】
A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中B与C同周期, C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍,所以C是O元素;C与F同主族,且是短周期元素,F是S元素;D与E和F同周期,D是所在周期原子半径最大的主族元素,D是Na元素;A与D同主族,且原子序数最小,为H元素;又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体,E处于钠和硫之间,所以是固体,则只能是A和B形成气体单质,A的原子序数小于B,A是H元素,B是N元素。
(1)钠位于第三周期第IA族
(2)离子的电子层数越多其半径越大,相同电子层结构的离子半径随着原子序数的增大而减小,所以离子半径大小顺序是S2-> O2-> Na+
(3) 由A、B、C三种元素以原子个数比4∶2∶3形成的化合物X是硝酸铵,硝酸铵中含有离子键、共价键。
(4)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,说明E是铝元素,高温下,铝和氧化铁能发生置换反应,化学方程式为2Al+Fe2O3![]() Al2O3+2Fe;若E是非金属元素,其单质在电子工业中有重要应用,E是硅,二氧化硅和强碱反应生成硅酸盐和水,离子方程式为:SiO2+2OH-=SiO32-+H2O
Al2O3+2Fe;若E是非金属元素,其单质在电子工业中有重要应用,E是硅,二氧化硅和强碱反应生成硅酸盐和水,离子方程式为:SiO2+2OH-=SiO32-+H2O
(5)二氧化硫有毒,和水反应生成亚硫酸,亚硫酸不稳定容易被氧气氧化生成硫酸,化学方程式为:2SO2+O2+2H2O===2H2SO4


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】新版人民币的发行,引发了人们对有关人民币中化学知识的关注。下列表述不正确的是( )
A. 制造人民币所用的棉花、优质针叶木等原料的主要成分是纤维素
B. 用于人民币票面文字等处的油墨中所含有的![]() 是一种磁性物质
是一种磁性物质
C. 某种化学验钞笔中含有碘酒溶液,遇假钞呈现蓝色,其中遇碘变蓝的是淀粉
D. 防伪荧光油墨由颜料与树脂连接料等制成,树脂与油脂一样,属于高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验发现,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量的铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中逐滴加入5mol/L NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示,下列说法不正确的是( )
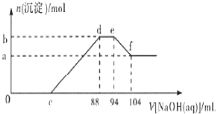
A.稀硝酸与铝粉、铁粉反应,其还原产物为硝酸铵
B.c点对应NaOH溶液的体积为48 mL
C.b点与a点的差值为0.05 mol
D.样品中铝粉和铁粉的物质的量之比为5:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.热的纯碱液去油污效果好,因为加热可使CO32-的水解程度增大,溶液碱性增强,去污力增强
B.铁在潮湿的环境下生锈以及Mg与NH4Cl溶液反应生成H2都与盐类水解有关
C.将Al2(SO4)3溶液加热、蒸干、灼烧,可得到固体Al2(SO4)3
D.将饱和FeCl3溶液滴入沸水中制胶体,离子方程式:Fe3++3H2O![]() Fe(OH)3(胶体) +3H+
Fe(OH)3(胶体) +3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第VIII族元素单质及其化合物在工业生产和科研领域有重要的用途。
(1)过渡元素Co 基态原子价电子排布式为_____。第四电离能I4 (Co) < I4 (Fe) ,其原因是_________。
(2)Ni(CO)4 常用作制备高纯镍粉,其熔点为-19.3 ℃, 沸点为 43 ℃。则:
①Ni(CO)4的熔、沸点较低的原因为__________。
②写出一种与CO互为等电子体的分子的化学式__________。
③Ni(CO)4中σ键和π键的数目之比为__________。
(3)NiSO4 常用于电镀工业,其中 SO42-的中心原子的杂化轨道类型为_______,该离子中杂化轨道的作用是__________。
(4)氧化镍和氯化钠的晶体结构相同,可看成镍离子替换钠离子,氧离子替换氯离子。 则:
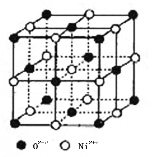
① 镍离子的配位数为__________。
② 若阿伏加德罗常数的值为NA,晶体密度为 ρ g·cm-3,则该晶胞中最近的 O2-之间的距离为__________pm(列出表达式)。
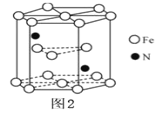
(5)某种磁性氮化铁的结构如图所示,Fe为__________堆积,则该化合物的化学式为__________。 其中铁原子最近的铁原子的个数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实现 “节能减排” 和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化。
CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化。
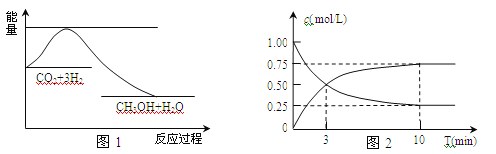
(1)关于该反应的下列说法中,正确的是_________(填字母)。
A.ΔH<0,ΔS<0 B.ΔH>0,ΔS<0
C.ΔH>0,ΔS>0 D.ΔH<0,ΔS>0
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和4 mol H2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
①从反应开始到平衡,H2的平均反应速率v(H2)=________;CO2的转化率w(CO2)=________。
②该反应的平衡常数K=_____________。(只列表达式和计算式,不必计算出结果)
③下列措施中能使化学平衡向正反应方向移动的是________________(填字母)。
A.将CH3OH(g)及时液化抽出 B.升高温度
C.选择高效催化剂 D.再充入l molCO2和4 molH2
(3)25℃,1.01×105Pa时,16 g 液态甲醇完全燃烧,当恢复到原状态时,放出350.8kJ的热量,写出该反应的热化学方程式:______________________。
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,其负极的电极反应式是:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用硫铁矿焙烧去硫后的烧渣(主要成分为Fe2O3、FeO、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),流程如下:
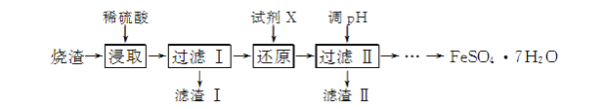
(1) 滤渣Ⅰ的主要成分是________(填化学式),滤渣Ⅱ的主要成分是________(填化学式)。
(2) 试剂X常选用SO2,写出“还原”过程中发生反应的离子方程式:________。
(3) 从分离出滤渣Ⅱ后的滤液中得到产品,应进行的操作是蒸发浓缩、________、过滤、洗涤、干燥。
(4) FeSO4·7H2O在医学上常用作补血剂。某课外小组通过以下实验方法测定某补血剂中亚铁离子的含量。
步骤a:取8片补血剂样品除去糖衣、研磨、溶解、过滤,将滤液配制成250 mL溶液;
步骤b:取上述溶液25 mL于锥形瓶中,加入少量硫酸酸化,逐渐滴加0.010 0 mol·L-1的KMnO4溶液,反应为5Fe2++MnO4-+8H+===5Fe3++Mn2++4H2O。记录滴定终点时消耗KMnO4溶液的体积(假定药品中其他成分不与KMnO4反应)。
步骤c:重复“步骤b”2~3次,平均消耗KMnO4溶液20.00 mL。
① 步骤a中配制250 mL溶液需要的玻璃仪器有烧杯、玻璃棒、________、胶头滴管。
② 该补血剂中亚铁离子的含量为________mg/片(请写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.髙锰酸钾在实验室和工农业生产中有广泛的用途,实验室以二氧化锰为主要原料制备高锰酸钾,其部分流程如下:

(1)第①步加热熔融应在铁坩埚中进行,而不用瓷坩埚的原因是_______________________________(用化学方程式表示)。
(2)第④步通人适量CO2,发生反应生成MnO4-、MnO2和碳酸盐,则发生反应的离子方程式为_______________________________。
(3)第⑥步加热浓缩至液面有细小晶体析出时,停止加热,冷却结晶、过滤、洗涤、干燥,干燥过程中,温度不宜过高,其原因是_________________(用化学方程式表)。
(4)H2O2和KMnO4都是常用的强氧化剂,若向H2O2溶液中滴加酸性髙锰酸钾溶液,则酸性髙锰酸钾溶液会褪色,写出该反应的离子方程式: ________________________________。
II.某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和C12的性质。

(5)若从左端分别通入SO2和C12,装置A中观察到的现象是否相同______(填“相同”或“不相同”)。
(6)若装置B中装有5.0 mL 1.0 mol L-1的碘水,当通入足量Cl2完全反应后,共转移了5. 0×10-2 mol电子,则该反应的化学方程式为____________________________。
(7)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4 : 3;当Cl2与含有X的溶液完全反应后,有浅黄色沉淀产生,取上层清液加人氯化钡溶液,有白色沉淀产生。 写出Cl2与含有X的溶液反应的离子方程式: __________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是工业制纯碱的部分物质转化示意图,下列说法错误的是

A. X是NH3,Y是CO2
B. M可在转化流程中循环利用
C. 若是联合制碱法,则L的主要成分是NH4Cl
D. 若是氨碱法,溶液c可在转化流程中循环利用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com