
 用如图所示的实验装置进行实验X及Y时,每隔半分钟分别测定放出气体的体积.下列选项中可正确表示实验X及Y的结果是( )
用如图所示的实验装置进行实验X及Y时,每隔半分钟分别测定放出气体的体积.下列选项中可正确表示实验X及Y的结果是( )| 实验 | 所用的酸 |
| X | 25mL 0.2mol/L |
| Y | 50mL 0.1mol/L |
A、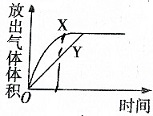 |
B、 |
C、 |
D、 |
| 2g |
| 24g/mol |
| 1 |
| 12 |
| 1 |
| 6 |
| 2g |
| 24g/mol |
| 1 |
| 12 |
| 1 |
| 6 |


科目:高中化学 来源: 题型:
| A、CO--酸性氧化物 Na2O2--碱性氧化物 Al2O3--两性氧化物 |
| B、漂白粉--混合物 胆矾--纯净物 HD--单质 |
| C、纯碱--碱 硫化氢--酸 小苏打--酸式盐 |
| D、盐酸--强电解质 硫酸钡--强电解质 醋酸--弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | A | B | C |
| 性质结构信息 | 单质在氯气中燃烧火焰呈黄色并产生大量白烟,所得产物的阳离子与D的阳离子电子数相同. | 单质是带有金属光泽的灰黑色固体,是信息技术的关键材料. | 最高价氧化物的水化物与其气态氢化物反应得到离子化合物D. |
查看答案和解析>>
科目:高中化学 来源: 题型:
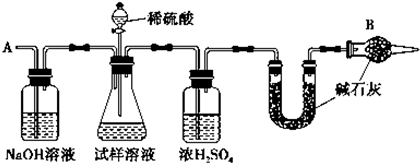
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 性质或原子结构 |
| A | 原子核内只有一个质子 |
| B | 单质是空气中含量最多的气体 |
| X | 原子的最外层电子数是次外层电子数的3倍 |
| Y | 短周期元素中原子半径最大的元素 |
| Z | 最高正化合价与最低负化合价的代数和为6 |
| 实验操作 | 实验现象 | 结论及解释 |
| ①取少量NaBr 溶液于试管中,滴加 ②再加入少量CCl4,振荡,静置. | ①溶液由无色变为橙黄色. ②溶液分层, | 氧化性:Z 单质>Br2 离子方程式 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com