
【题目】碳酸钡是一种重要的无机盐产品,广泛应用于工业陶瓷、光学玻璃、建筑等行业.碳化法生产碳酸钡的工艺流程示意图如下: 
已知:重晶石的主要成分是BaSO4;Ba(HS)2溶液呈弱碱性;2BaS+2H2O=Ba(OH)2+Ba(HS)2 .
回答下列问题:
(1)煅烧时发生反应的化学方程式为 , 该反应的氧化产物的电子式为;当温度过高时,尾气中有毒气体的含量会升高,原因是(用化学方程式表示).
(2)为了提高浸取速率,可采取的措施是(任写一种).
(3)碳化时发生反应的离子方程式为 .
(4)脱硫过程是用Na2CO3溶液将BaCO3浆液中含有的BaS2O3除去:CO32﹣+BaS2O3=BaCO3+S2O32﹣ , 该反应的平衡常数为【已知Ksp(BaCO3)=2.5×10﹣9 , Ksp(BaS2O3)=1.6×10﹣5】.
(5)Ba(HS)2溶液中离子浓度由大到小的顺序为 , 用等式表示溶液中所有离子之间的关系: .
(6)BaCO3不能用于医疗用的“钡餐”,原因是 .
【答案】
(1)BaSO4+2C ![]() BaS+2CO2↑;
BaS+2CO2↑;![]() ;CO2+C
;CO2+C ![]() 2CO
2CO
(2)适当提高温度(或搅拌等)
(3)CO2+H2O+Ba2++2HS﹣=BaCO3↓+2H2S↑
(4)6.4×103
(5)c(HS﹣)>c(Ba2+)>c(OH﹣)>c(H+)>c(S2﹣);2c(Ba2+)+c(H+)=c(HS﹣)+2c(S2﹣)+c(OH﹣)
(6)BaCO3与胃酸中的盐酸反应生成可溶性的重金属盐BaCl2 , 会使人中毒
【解析】解:(1)碳酸钡粉碎后煅烧和碳反应生成硫化钡和二氧化碳,反应的化学方程式为:BaSO4+2C ![]() BaS+2CO2↑,反应中碳元素化合价升高失电子做还原剂被氧化得到氧化产物二氧化碳,二氧化碳中存在两个碳氧双键,属于共价化合物,电子式为:
BaS+2CO2↑,反应中碳元素化合价升高失电子做还原剂被氧化得到氧化产物二氧化碳,二氧化碳中存在两个碳氧双键,属于共价化合物,电子式为: ![]() ,高温下碳和二氧化碳反应生成有毒气体一氧化碳:CO2+C
,高温下碳和二氧化碳反应生成有毒气体一氧化碳:CO2+C ![]() 2CO;所以答案是:BaSO4+2C
2CO;所以答案是:BaSO4+2C ![]() BaS+2CO2↑;
BaS+2CO2↑; ![]() ;CO2+C
;CO2+C ![]() 2CO;(2)提高浸取速率可以升温、搅拌、粉碎增大接触面积等措施;所以答案是:适当提高温度(或搅拌等);(3)碳化时Ba(HS)2和H2S气体粉碎反应生成碳酸钡沉淀和硫化氢气体,反应的离子方程式为:CO2+H2O+Ba2++2HS﹣=BaCO3↓+H2S↑;所以答案是:CO2+H2O+Ba2++2HS﹣=BaCO3↓+2H2S↑;(4)CO32﹣+BaS2O3═BaCO3+S2O32﹣ , 该反应的平衡常数K=
2CO;(2)提高浸取速率可以升温、搅拌、粉碎增大接触面积等措施;所以答案是:适当提高温度(或搅拌等);(3)碳化时Ba(HS)2和H2S气体粉碎反应生成碳酸钡沉淀和硫化氢气体,反应的离子方程式为:CO2+H2O+Ba2++2HS﹣=BaCO3↓+H2S↑;所以答案是:CO2+H2O+Ba2++2HS﹣=BaCO3↓+2H2S↑;(4)CO32﹣+BaS2O3═BaCO3+S2O32﹣ , 该反应的平衡常数K= ![]() =
= ![]()
![]() =
= ![]() =6.4×103;所以答案是:6.4×103;(5)Ba(HS)2溶液中溶质是强碱弱酸盐,HS﹣离子水解程度大于其电离程度溶液显碱性,溶液中离子浓度大小为:c(HS﹣)>c(Ba2+)>c(OH﹣)>c(H+)>c(S2﹣),溶液中存在电荷守恒2c(Ba2+)+c(H+)=c(HS﹣)+2c(S2﹣)+c(OH﹣);所以答案是:c(HS﹣)>c(Ba2+)>c(OH﹣)>c(H+)>c(S2﹣);2c(Ba2+)+c(H+)=c(HS﹣)+2c(S2﹣)+c(OH﹣);(6)碳酸钡与稀盐酸反应生成氯化钡、水和二氧化碳,该反应的化学方程式为:BaCO3+2HCl=BaCl2+CO2↑+H2O,BaCO3与胃酸中的盐酸反应生成可溶性的重金属盐氯化钡会使人中毒;所以答案是:BaCO3 与胃酸中的盐酸反应生成可溶性的重金属盐BaCl2 , 会使人中毒.
=6.4×103;所以答案是:6.4×103;(5)Ba(HS)2溶液中溶质是强碱弱酸盐,HS﹣离子水解程度大于其电离程度溶液显碱性,溶液中离子浓度大小为:c(HS﹣)>c(Ba2+)>c(OH﹣)>c(H+)>c(S2﹣),溶液中存在电荷守恒2c(Ba2+)+c(H+)=c(HS﹣)+2c(S2﹣)+c(OH﹣);所以答案是:c(HS﹣)>c(Ba2+)>c(OH﹣)>c(H+)>c(S2﹣);2c(Ba2+)+c(H+)=c(HS﹣)+2c(S2﹣)+c(OH﹣);(6)碳酸钡与稀盐酸反应生成氯化钡、水和二氧化碳,该反应的化学方程式为:BaCO3+2HCl=BaCl2+CO2↑+H2O,BaCO3与胃酸中的盐酸反应生成可溶性的重金属盐氯化钡会使人中毒;所以答案是:BaCO3 与胃酸中的盐酸反应生成可溶性的重金属盐BaCl2 , 会使人中毒.


科目:高中化学 来源: 题型:
【题目】[Zn(CN)4]2﹣在水溶液中与HCHO发生如下反应: 4HCHO+[Zn(CN)4]2﹣+4H++4H2O═[Zn(H2O)4]2++4HOCH2CN
(1)Zn2+基态核外电子排布式为 .
(2)1mol HCHO分子中含有σ键的数目为mol.
(3)HOCH2CN分子中碳原子轨道的杂化轨道类型是 .
(4)与H2O分子互为等电子体的阴离子为 .
(5)[Zn(CN)4]2﹣中Zn2+与CN﹣的C原子形成配位键,不考虑空间构型,[Zn(CN)4]2﹣的结构可用示意图表示为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既不是氧化剂也不是还原剂.下列反应与Cl2+SO2+2H2O=H2SO4+2HCl相比较,水的作用完全相同的是( )
A.2H2O ![]() 2H2↑+O2↑
2H2↑+O2↑
B.4Fe(OH)2+O2+2H2O=4Fe(OH)3
C.2Na+2H2O=2NaOH+H2↑
D.Cl2+H2O=HCl+HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4和H2O(g)可发生催化重整反应:CH4(g)+H2O(g)CO(g)+3H2(g).
(1)每消耗8gCH4转移mol电子.
(2)已知:①2CO(g)+O2(g)2CO2(g)△H1=akJmol﹣1②CO(g)+H2O(g)CO2(g)+H2(g)△H2=bkJmol﹣1
③CH4(g)+2O2(g)CO2(g)+2H2O(g)△H3=ckJmol﹣1
④CH4(g)+2H2O(g)CO(g)+3H2(g)△H4
由此计算△H4=kJmol﹣1 .
(3)T℃时,向1L恒容密闭容器中投入1molCH4和1molH2O(g),发生反应:CH4(g)+H2OCO(g)+3H2(g) 经过tmin,反应达到平衡.已知平衡时,c(CH4)=0.5molL﹣1
①0~tmin内,该反应的平衡反应速率v(H2)= .
②T℃时,该反应的平衡常数K= .
③当温度升高到(T+100)℃时,容器中c(CO)=0.75molL﹣1 , 则该反应是反应(填“吸热”或“放热”).
(4)一种熔融碳酸盐燃料电池的工作原理示意图如图: ①该放电过程中K+和Na+向电极(填“A”或“B”)移动.
②该电池的负极反应式为 . 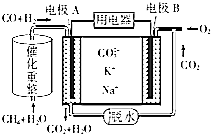
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X表面有Z析出,X与Y组成原电池时,Y为负极。X、Y、Z三种金属的活动性顺序为
A.Y>Z>X B.X>Z>Y C.X>Y>Z D.Y>X>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.NH3、CO、CO2都是极性分子
B.CH4、CCl4都是含有极性键的非极性分子
C.HF、HCl、HBr、HI的稳定性依次增强
D.CS2、H2O、C2H2都是直线形分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中错误的是( )
A. 进行蒸发操作时,玻璃棒的作用与溶解操作时一样
B. 进行蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C. 进行分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D. 进行萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如图.下列叙述正确的是( ) 
A.迷迭香酸属于芳香烃
B.迷迭香酸可以发生水解、消去、取代和酯化反应
C.1mol迷失香酸最多能和含6mol NaOH的水溶液完全反应
D.1mol迷迭香酸最多能和9mol氢气发生加成,和6mol溴发生取代反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com