
��һ���¶��£���6 mol C02��8 mol H2����2L�����ܱ������У��������·�Ӧ��
CO2(g) + 3H2(g)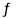 CH30H(g) + H20(g) ��H �� O
CH30H(g) + H20(g) ��H �� O
�ֱ���tʱ����ڸ�������n(H2)����ֵ���£�
t/min | 1 | 4 | 8 | 11 |
n(H2)/mol | 6 | 2.6 | 2 | 2 |
������˵����ȷ����
A�����¶��£�ƽ�ⳣ��K = 0.5
B����Ӧ����4minʱ��V��(C02) = 0.45 mol/(L��min)
C����Ӧ���е�9minʱ��H2��ת���ʱ�8minʱ��
D����Ӧ����11min��������������ѹǿ��CO2��ת����һ������
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���½���³ľ����������ڶ�������Բ��Ի�ѧ�Ծ��������棩 ���ͣ������
(10��)��֪������(SO2Cl2)��һ���л��Ȼ�����SO2(g)��Cl2(g)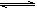 SO2C12(g)
SO2C12(g) 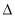 H��0��SO2Cl2��һ����ɫҺ�壬�۵㡪54.1 �棬�е�69.1 �棬����ˮ�⣬����ʪ���������������
H��0��SO2Cl2��һ����ɫҺ�壬�۵㡪54.1 �棬�е�69.1 �棬����ˮ�⣬����ʪ���������������
��1��������SO2Cl2��SԪ�صĻ��ϼ��� ��
��2���ö������̺�Ũ�����������Ļ�ѧ����ʽΪ ��
��3������ͼ��ʾ��װ���Ʊ�SO2Cl2������˵����ȷ�� (ѡ����)
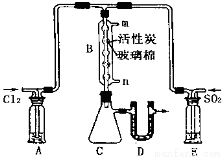
a��A��E��ϴ��ƿ��ʢ�ŵĿ��ֱܷ��DZ���ʳ��ˮ�ͱ���NaHSO3��Һ
b��B����Ӧ���������в������ϵĻ���̼������
c��װ��C������ƿӦ���ڱ�ˮ����ȴ����������SO2Cl���ռ�
��4��B����Ӧ����ȴˮӦ�� (�m����n��)�ӿ�ͨ�룬
�ӻ�ѧƽ���ƶ��Ƕȷ�������Ӧ��ͨˮ��ȴ��Ŀ���� ��D��U�ι���ʢ�ŵ��Լ������� ��
��5����C������Һ���м�ˮ�����ְ����������õõ���ɫ��Һ�����������Һ�е�������ֻ��SO42����Cl��(OH������)��д��SO2Cl2��H2O��Ӧ�Ļ�ѧ����ʽ ��
��6����֪�����£�Ksp[AgCl]��2.0��10��10��Ksp[Ag2SO4]��1.6��10��5����SO2Cl2����ˮ������Һ����μ���AgNO3ϡ��Һ��ʹSO42����Cl����ȫ����������Һ��Ag��Ũ��Ϊ0.1 mol/Lʱ������Һ��Cl����SO42�������ʵ���Ũ��֮��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡ֣���и����ڶ�������Ԥ�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
��ͼ�Dz��ֶ�����Ԫ��ԭ������������������֮�ʵĹ�ϵͼ������˵������ȷ����

A��Ԫ�ض�Ӧ�����Ӱ뾶:Z��M��R��W
B�����⻯��ķе�:W��R��Y��X
C��M��N��R��W�ļ����Ӿ��ܴٽ�ˮ�ĵ���
D��Z��X��R��W������������Ӧ��ˮ���������N�ĵ��ʷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�걱������ͷ��������3���ۺ���ϰ���ۻ�ѧ�Ծ��������棩 ���ͣ������
��16�֣��ϳ��л�������֬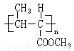 �߾���H�ĺϳ�·�����£�
�߾���H�ĺϳ�·�����£�

��֪��
RCOOR��+ R��OH  RCOOR�� + R��OH ��R��R�䡢R�����������
RCOOR�� + R��OH ��R��R�䡢R�����������
CH2=CH��CH=CH2��CH2=CH2 

�Իش�
��1��E�й����ŵ������� ��
��2��C��D�ķ�Ӧ������ ��D��E��Ӧ�ġ�һ���������� ��
��3������˵����ȷ����(ѡ����ĸ) ��
A���ҿ�ʹBr2��CCl4��Һ��ɫ
B��G���Ҷ�����Ϊͬϵ��
C��D�ĺ˴Ź���������4��壬�ҷ����֮��Ϊ3:1:1:1
D�������л�������֬�߾���H��Ϊ�Ӿ۷�Ӧ
��4��B��C�Ļ�ѧ����ʽ�� ��
��5���ҵ�ͬ���칹���к����������� �֣�д�������ܷ���������Ӧ��һ��ͬ���칹��Ľṹ��ʽ ��
��6�����ɸ߾���H�Ļ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�걱������ͷ��������3���ۺ���ϰ���ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����д����л�ѧ��Ӧ���������ʶ�����������;�Ľ��Ͳ���ȷ����
A | B | C | D | |
��; | �ȵĴ�����Һ��ȥ���� | ���������ھ�ˮ | ����Ѫ�ᣨVc�������������� | Һ����������� |
���� | ����ˮ��ʼ��� | ������ˮ�����ɵ��������������������� | Vc�������� | Һ������ʱ���մ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�걱���з�ɽ������һģ���ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
ͨ����ˮ��pH=8.1�����ȶ���ˮpH�������õ�������
A��Na+ B��HCO3- C��CO32- D��Cl-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���㽭ʡ̨���и���3�µ��п������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
��25��Cʱ����10mL 0.0lmol�� L-1NaCN��Һ����μ���0.0lmol��L-1�����ᣬ�ζ�������ͼ1��ʾ��CN����HCNŨ����ռ����(��)��pH�仯�Ĺ�ϵ��ͼ2��ʾ�����б� ����ȷ���� 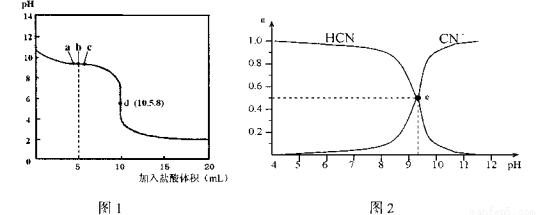
A��b��ʱ����Һ����Ũ�ȴ�С�Ĺ�ϵ��c(CN��)>c(Cl-)>c(HCN)>c<(OH��)>c(H+)
B��d ����Һ���ڵĹ�ϵ��c(Na+) + c(H+) = c(HCN) + c(OH��) + 2c(CN��)
C��ͼ2�е�e���Ӧͼ1�е�c��
D���ڵζ�������ѡ�÷�̪�Լ���ѡ�ü����Լ���ָʾ������С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡ�����и����ڶ���ͳһ�������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����й�ʵ�����������ȷ����
A��ȼ�ŵľƾ��Ʋ�������ʧ��Ӧ������ʪ������
B������к͵ζ�ʵ���У��ζ��ܺ���ƿ��Ҫ�ô�װ��Һ��ϴ
C����Ũ��ˮϴ������������Ӧ���Թ�
D����ij��Һ��pHʱ����pH��ֽ���������Һ�У���һ���ȡ���������ɫ�����жԱ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡ��У���������������ۻ�ѧ�Ծ��������棩 ���ͣ������
����14�֣���1��������ʡ����ѧԺ(MIT)��������Ƴ�þ��Һ̬������أ��乤��ԭ����ͼ��ʾ����������ʧȥ���ӣ���ͨ�����·�������������������ӻ���ͨ������Ǩ�Ƶ������������������Ͻ������ִ���෴�Ĺ��̡�

д����طŵ�ʱ��������ӦʽΪ ��
��2���ҹ�����̲���ռ�����һλ�������Sb2S3��������Ҫ���ijұ�������������Ȼ���ˮ��Һ�ĵ���о���Ȼ�����õ��������������ɵ����Ȼ�����Ϊ���������Ի����������Խ������Ӷ�ʵ�ֽ���-���ı�·ѭ��������˴�ͳ��������С���ҵ���ϡ��ŷ���������⡣������ͼ��
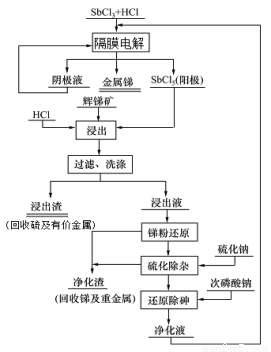
��д����Ԫ�������ڱ��е�λ�� ��
�ڡ���ҵ���ϡ�ָ���� ��
�۵�������������Ҫ��Sb3+��������Sb5+����д�������ĵ缫��Ӧʽ ��
�ܸ�������ͼд�������������跢����Ӧ�Ļ�ѧ����ʽ ��
����֪����Һ�г�Sb3+�⣬����Cu2+��Pb2+���ؽ������ӣ�����c(Cu2+)=1.6��10��3mol��L��1�������Һ�м�����������Һ�е�Cu2+�պ���ȫ��������c(S2��)= ������֪Ksp(CuS)=8��10��45 Ksp(PbS)=3.4��10��28��
��ԭ�����ԭ���ǣ��ڴ���4mol��L��1��HCl��Һ�У��Դ������ƣ�Na3PO2������ԭ�����������¶ȣ�ʹAsCl3����ԭΪ��ɫ���������������ƽ�÷�Ӧ�Ļ�ѧ����ʽ:
AsCl3 + Na3PO2 + HCl + H2O = As ��+ H3PO3 + NaCl
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com