
| A. | 硫酸、胆矾、氯化镁 | B. | 硝酸、烧碱、干冰 | ||
| C. | 醋酸、消石灰、明矾 | D. | 盐酸、生石灰、石膏 |
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ③④ | C. | ②④⑤ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
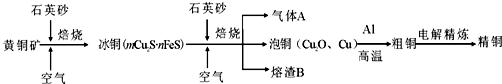
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
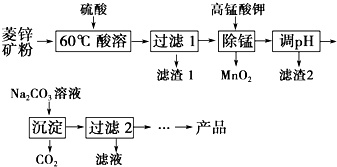 以菱锌矿(主要成分为ZnCO3,同时含有MnO、FeO、Fe2O3、SiO2等杂质)为原料生产碱式碳酸锌[ZnCO3•2Zn(OH)2•H2O]的工艺流程如图.已知Fe2+、Fe3+、Zn2+生成氢氧化物沉淀的pH见表:
以菱锌矿(主要成分为ZnCO3,同时含有MnO、FeO、Fe2O3、SiO2等杂质)为原料生产碱式碳酸锌[ZnCO3•2Zn(OH)2•H2O]的工艺流程如图.已知Fe2+、Fe3+、Zn2+生成氢氧化物沉淀的pH见表:| 待沉淀离子 | Fe2+ | Fe3+ | Zn2+ |
| 开始沉淀时pH | 5.8 | 1.1 | 5.9 |
| 完全沉淀时pH | 8.8 | 3.2 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaAlO2溶液中通入过量的CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- | |
| B. | 向FeCl3溶液中滴加KSCN溶液:Fe3++3SCN-═Fe(SCN)3↓ | |
| C. | 向NaHCO3溶液中加过量Ca(OH)2溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| D. | 向BaCO3固体中加入过量的稀H2SO4:BaCO3+2H+═Ba2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
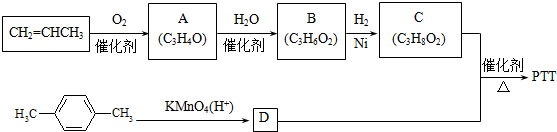
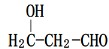 .
.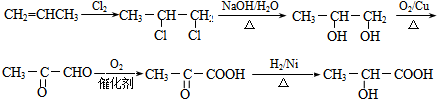 .
.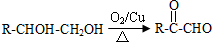
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | Y | Z | M | R | Q | |
| 原子半 径/nm | 0.154 | 0.074 | 0.099 | 0.143 | ||
| 主要 化合价 | -4, +4 | -2 | -1,+7 | +3 | ||
| 其他 | 阳离子核 外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com