
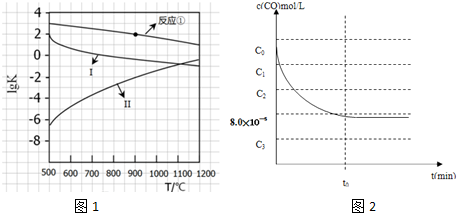
| 1 |
| 4 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 4 |
| 1 |
| 4 |
| c(CO2) |
| c(CO) |
| c0-8.0×10-5 |
| 8.0×10-5 |
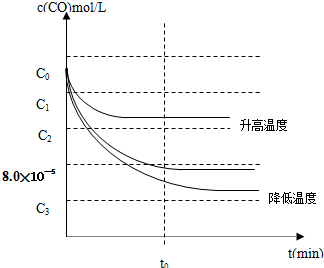 ,故答案为:99%;
,故答案为:99%; .
.


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
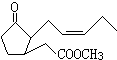 美国《Science》杂志报道了“关于植物是怎样互相窃听从而发现附近是否有一个很饿的食草动物”,提出了关于植物能释放出化学“云”(挥发性有机物)的假设.下面就是一种化学“云”-茉莉酮酸酯的结构简式,有关该物质的说法正确的是( )
美国《Science》杂志报道了“关于植物是怎样互相窃听从而发现附近是否有一个很饿的食草动物”,提出了关于植物能释放出化学“云”(挥发性有机物)的假设.下面就是一种化学“云”-茉莉酮酸酯的结构简式,有关该物质的说法正确的是( )| A、该有机物能使酸性高锰酸钾溶液褪色 |
| B、1mol该有机物最多可以和3molH2发生加成反应 |
| C、该有机物可以发生银镜反应 |
| D、该物质在酸性条件下的水解比在碱性条件下的水解程度大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝与氢氧化钠溶液反应:2Al+2 OH-=2AlO2-+3H2O |
| B、将磁性氧化铁溶于盐酸:Fe3O4+8H+=3Fe3++4H2O |
| C、用氢氧化钠溶液除去铝表面的氧化膜:Al2O3+2OH-=2AlO2-+H2O |
| D、过氧化钠溶于盐酸:Na2O2+2H+=2Na++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
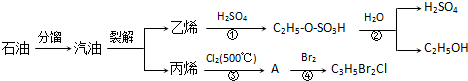
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 |
| B、过量的SO2通入NaOH溶液中:SO2+2OH-═SO32-+H2O |
| C、等体积、等物质的量浓度的NaHCO3和 Ba(OH)2两溶液混合:2HCO3-+Ba2++2OH-═BaCO3↓+CO32-+2H2O |
| D、NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+═2Mn2++5NO3-+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、亚硝酸钠(发色剂) |
| B、山梨酸(防腐剂) |
| C、苯甲酸(防腐剂) |
| D、维生素(营养强化剂) |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、Ⅰ、Ⅱ装置之间缺少干燥装置 |
| B、Ⅱ装置中的CuO粉末可能不干燥 |
| C、CuO没有全部被还原 |
| D、Ⅲ装置后缺少干燥装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaOH |
| B、NaCl |
| C、Ca(OH)2 |
| D、Na2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com