
| 选项 | Ⅰ | Ⅱ | Ⅲ |
| A | 稀氨水 | Al3+ | Mg2+ |
| B | 新制氯水、CCl4 | I- | Cl- |
| C | KSCN溶液、新制氯水 | Fe2+ | Fe3+ |
| D | 稀盐酸、BaCl2溶液 | SO42- | SO32- |
| A、A | B、B | C、C | D、D |


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
| A、H2O2的结构式:H-O-H-O |
B、硫离子的结构示意图: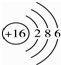 |
C、二氧化碳的比例模型: |
| D、氧化铁的化学式:FeO |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 | 现象 | 结论 |
| 将0.5mL浓溴水加入盛2mL苯的试管中 | ① | 苯酚分子中苯环上的氢原子比苯分子上的氢原子③ |
| 将0.5mL浓溴水加入盛2mL稀苯酚溶液的试管中 | ② |
| 乙醚 |
| 室温 |
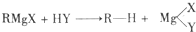 ,Y为-OH、-OR、-X(卤原子)、-NH2等.格林试剂是有机合成中用途甚广的一种试剂,它可以与羰基加成,发生反应:
,Y为-OH、-OR、-X(卤原子)、-NH2等.格林试剂是有机合成中用途甚广的一种试剂,它可以与羰基加成,发生反应: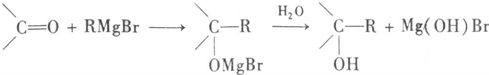
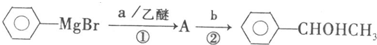
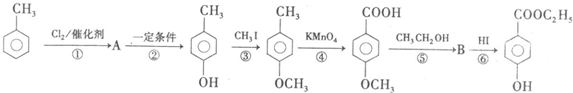
查看答案和解析>>
科目:高中化学 来源: 题型:
 阅读下列实验内容,根据题目要求回答问题.
阅读下列实验内容,根据题目要求回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:
2- 4 |
| H+ |
| 转换 |
2- 7 |
| Fe2+ |
| 还原 |
| OH- |
| 沉淀 |
2- 4 |
2- 7 |
| 10 |
| 11 |
| A、溶液颜色保持不变,说明上述可逆反应达到平衡状态 |
| B、若用绿矾(FeS04?7H20)(M=278)作还原剂,处理1 L废水,至少需要917.4 g |
| C、常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=6 |
| D、常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol/L,应调溶液的pH=5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
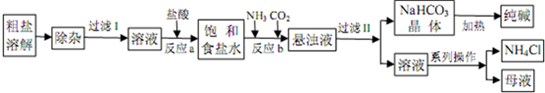
| 等级 | 优等品 | 一等品 | 合格品 |
| Na2CO3含量 | ≥99.2 | ≥98.8 | ≥98.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AgCl沉淀生成和沉淀溶解不断进行,但速率相等 |
| B、AgCl难溶于水,溶液中没有Ag+和Cl- |
| C、升高温度,AgCl沉淀的溶解度减小 |
| D、向AgCl沉淀中加入NaCl固体,AgCl沉淀不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入AgNO3溶液,生成白色沉淀,再加入稀盐酸,沉淀不溶解,可确定有Cl-存在 |
| B、用洁净铂丝蘸取该溶液在火焰上灼烧,产生黄色火焰,则原溶液中一定含有Na+ |
| C、加入HCl溶液,生成无色无味气体,该气体能使澄清石灰水变浑浊,则原溶液中一定含有CO32- |
| D、加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不溶解,可确定有SO42-存在 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com