
物质的量为0.3mol的![]() 在加热条件下与足量稀硝酸反应,生成产物有
在加热条件下与足量稀硝酸反应,生成产物有![]() 、
、![]() 和
和![]() .则在参加反应的硝酸中,被还原的硝酸的物质的量为
.则在参加反应的硝酸中,被还原的硝酸的物质的量为
[ ]
|
A.2.2mol |
B.1.0mol |
|
C.1.2mol |
D.1.6mol |
 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:阅读理解
| 阳离子 | Ba2+ NH4+ Fe3+ Al3+ Fe2+ |
| 阴离子 | OH- CO32- Cl- SO32- SO42- |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

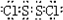
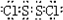

 .
.查看答案和解析>>
科目:高中化学 来源:高中化学习题1 题型:013
物质的量为0.3mol的![]() 在加热条件下与足量稀硝酸反应,生成产物有
在加热条件下与足量稀硝酸反应,生成产物有![]() 、
、![]() 和
和![]() .则在参加反应的硝酸中,被还原的硝酸的物质的量为
.则在参加反应的硝酸中,被还原的硝酸的物质的量为
[ ]
A.2.2mol B.1.0mol
C.1.2mol D.1.6mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com